Texto universitario

_____________________________
Modulo 3. Oxígeno
3.1 Contexto: el oxígeno
Parecería que una introducción al oxígeno es innecesaria, ya que nos ocupamos de él y dependemos de él en cada momento de nuestra vida. El oxígeno es para nosotros la sustancia esencial del aire que respiramos. Somos animales aeróbicos que obtenemos energía oxidando los alimentos. Como tal, somos totalmente dependientes del oxígeno de por vida; si no lo usamos durante un par de minutos, nos entra el pánico e incluso podemos sufrir un daño cerebral irreversible. En unos minutos más, perecemos. El metabolismo animal depende del oxígeno para casi todos sus procesos de generación de energía. Sin embargo, esto no siempre fue así. Al principio de la historia de la Tierra, esencialmente no había oxígeno libre en ninguna parte, aunque el oxígeno siempre ha sido uno de los elementos más abundantes en la Tierra. En la Tierra primitiva, prácticamente todo el oxígeno estaba ligado a compuestos, principalmente agua y rocas de silicato. Los microbios primitivos manejaban la vida sin oxígeno libre. Aún persisten ejemplos de este metabolismo anaeróbico menos eficiente, como las bacterias que viven en ambientes pobres en oxígeno.
Sorprendentemente, así como la mayor parte de la vida actual depende del oxígeno, también el suministro de oxígeno libre de la Tierra depende, a su vez, de la vida. Prácticamente todo el oxígeno libre en nuestro entorno proviene de la fotosíntesis de las plantas, y fue la invención evolutiva de este proceso, lo que convirtió el mundo inicialmente anaeróbico en nuestro mundo aeróbico actual. Nuestra Tierra es el único planeta del sistema solar que exhibe cantidades significativas de oxígeno libre, lo que puede significar que la Tierra es el único en el que ha evolucionado la vida (o al menos la vida avanzada).
La introducción de oxígeno en un mundo anaeróbico trajo problemas para los organismos existentes en ese momento, ya que muchos de los subproductos del metabolismo del oxígeno son sustancias tóxicas. Se tuvieron que erigir defensas químicas contra estos; todavía los encontramos en nuestra propia química hoy. Por otro lado, ciertos organismos desarrollaron vías metabólicas aeróbicas, mucho más eficientes que las anaeróbicas. Estos fueron los antepasados ??de todos los animales y plantas superiores.
Aún existen razones más profundas por las que el oxígeno es esencial para la vida. El agua es el medio ideal para los procesos y estructuras biológicos, y el oxígeno es esencial para el agua. Además, el elemento hidrógeno es necesario en casi todos los compuestos y estructuras orgánicos, pero el hidrógeno libre se pierde fácilmente en el espacio desde un planeta pequeño como el nuestro. Solo en virtud de la unión del hidrógeno con el oxígeno para formar agua, queda una cantidad significativa de este elemento vital en la Tierra. Sin unirse al oxígeno, casi todo el hidrógeno se habría perdido hace mucho tiempo.
Este manuscrito explorará la historia del oxígeno, desde su génesis en las estrellas hasta su papel en la remodelación de la Tierra y sus criaturas. Encontraremos que su historia está entrelazada con la historia geológica y evolutiva de formas notables y a menudo inesperadas. Pero para entender esto, es mejor considerar primero algunas propiedades fundamentales de este intrigante elemento, propiedades que le han permitido tocar su nota única y la que proviene directamente de su estructura atómica. Por tanto, es necesaria una introducción al oxígeno.
Lo que puede hacer un elemento, qué compuestos formará y qué propiedades tiene depende de su estructura atómica. Comenzamos nuestro análisis del oxígeno con el núcleo del átomo, el núcleo. El número de protones en un núcleo da su número atómico y su carga positiva. Suma el número de neutrones y tienes la masa atómica. El núcleo del isótopo más común de oxígeno contiene ocho protones y ocho neutrones, por lo que tiene un número atómico de 8 y 16 unidades de masa atómica. Se designa en notación convencional como 16O. Existen otros isótopos (principalmente 17O y 18O) que difieren en el número de neutrones, pero se encuentran en la naturaleza en cantidades muy pequeñas. Con ocho protones cargados positivamente, se necesitan ocho electrones negativos para formar un átomo neutro. La teoría de la mecánica cuántica nos dice cómo deben distribuirse estos electrones en el espacio alrededor del núcleo. Esto no está en las "órbitas" circulares descritas en las teorías atómicas anteriores (y a menudo todavía en ilustraciones populares). Más bien, de acuerdo con la mecánica cuántica, solo podemos describir las distribuciones de electrones en términos de "orbitales", regiones en el espacio donde es más probable que se encuentren los electrones. Existen reglas estrictas de la mecánica cuántica que regulan cómo los orbitales se pueden llenar a medida que agregamos electrones a un núcleo. Los orbitales disponibles para el estado de energía más bajo se describen a continuación. Hay un orbital de energía más baja, más cercano al núcleo, llamado 1s, que es un poder esférico simétrico alrededor del núcleo. Más lejos del núcleo hay un orbital 2s simétrico, y luego cuatro orbitales llamados 2p. Estos últimos son asimétricos y direccionales.
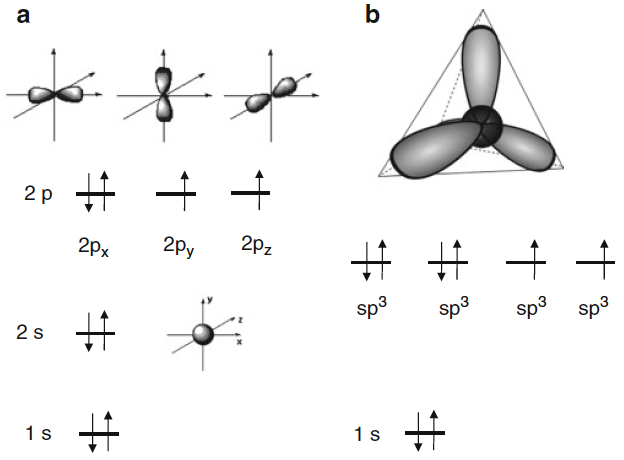
Fig. 1.1 Orbitales de oxígeno. a) Orbitales atómicos de menor energía para el oxígeno; aquí se representan (no a escala) los orbitales 2s y 2p; los que están disponibles para el oxígeno. El orbital 1s es esférico y se concentra más cerca del núcleo que el 2s. La ocupación del estado fundamental por electrones es indicado por las flechas que denotan giro. (b) Orbitales híbridos. hibridación sp3. Se producen cuatro orbitales mediante una "mezcla" de un 2s y tres orbitales 2p que apuntan a los cuatro bordes de un tetraedro.
Una regla fundamental es que cada orbital no puede aceptar más de dos electrones, y estos pares deben ser de espín opuesto. Originalmente, el espín se interpretó como suena, un "giro" del electrón, pero una interpretación de la mecánica cuántica simplemente enfatizaría diferentes respuestas a un campo magnético. Cada electrón tiene solo dos posibilidades para su espín, designadas + o -. Usamos aquí solo algunos conceptos generales de la mecánica cuántica.
Ahora tenemos suficiente información para describir las posibles estructuras electrónicas del átomo de oxígeno. Con ocho electrones para distribuir, primero colocamos dos en el orbital 1s, dos en el 2s y quedan cuatro para los 2p's. En general, la energía total más baja se obtiene emparejando electrones de espín opuesto, por lo que al formar el estado fundamental (el estado de energía más baja) llenamos solo dos de los orbitales 2p, dejando dos vacíos.
Tenga en cuenta que al formar enlaces con otros átomos a través de los orbitales de 2px, 2py y 2pz, los ángulos de banda estarán cerca de 90º y, por lo tanto, serán forzados de manera incómoda. Para aliviar esa tensión, el oxígeno y algunos otros átomos como el carbono, al menos cuando forman compuestos, en realidad reorganizan algo los orbitales. Los orbitales 2s y 2p se mezclan o “hibridan” para formar cuatro orbitales “híbridos” sp3 que apuntan hacia las esquinas de un tetraedro. Hay seis electrones para poner en este conjunto (dos 2 electrones y cuatro electrones 2p). Dos orbitales tendrán electrones emparejados de espín, y dos tendrán cada uno un electrón desapareado. Estos orbitales sp3 apuntan en la dirección hacia las cuatro esquinas de un tetraedro con ángulos de enlace de aproximadamente 109º. Con estas sencillas reglas, estamos en condiciones de explicar los aspectos más importantes de la química del oxígeno. Primero, tenga en cuenta que cuando un átomo tiene orbitales parcialmente llenos, casi siempre es energéticamente favorable llenarlos. Con el átomo de oxígeno, esto se puede hacer de dos formas diferentes. Primero, el oxígeno puede simplemente ganar dos electrones de algún otro átomo (un metal M, por ejemplo) para formar un compuesto iónico en el que el oxígeno existe como ion óxido, O2-. Por ejemplo:
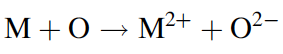
Alternativamente, el oxígeno puede compartir dos electrones con otro átomo o átomos, en enlaces covalentes. Esto es lo que sucede cuando el oxígeno se combina con el hidrógeno para formar agua. El ángulo entre los dos enlaces oxígeno-hidrógeno es 104,5º, siendo ligeramente diferente del valor esperado para un tetraedro (109,5º) como consecuencia de la repulsión electrón-electrón entre los dos pares de electrones. Los enlaces covalentes del oxígeno son bastante estables y gran parte de la química de la Tierra se explica por este hecho. Por ejemplo, la abundancia y estabilidad de los silicatos como el cuarzo, que componen gran parte de la corteza terrestre, depende de la fuerza del enlace covalente Si-O y la gran cantidad de agua depende de los enlaces O-H.
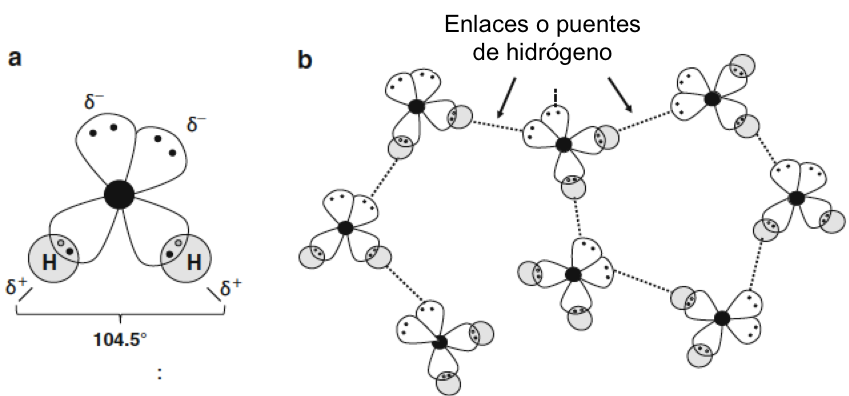
Fig. 1.2 (a) Estructura del agua. La estructura electrónica de una molécula de agua individual: los pares de electrones no enlazados de los dos orbitales pueden actuar como aceptores de hidrógeno. El átomo de oxígeno (O) en el centro se muestra en negro, el hidrógeno (H) en gris. Los símbolos δ- y δ+ indican la carga parcial en los dos lados de la molécula. El ángulo entre los dos orbitales de enlace de hidrógeno es 104.5º en lugar de 109º en una hibridación sp3 en estado tetraédrico. (b) Enlace de hidrógeno en agua entre moléculas de agua. Cada molécula actúa como donante y aceptor de hidrógeno, lo que permite que se formen grupos de moléculas de agua.
El oxígeno puede formar enlaces covalentes con varios elementos, pero los que tienen carbono son excepcionalmente importantes para la vida. La enorme variedad de estos "orgánicos" compuestos se enriquece con las numerosas posibilidades de enlace O-C, como en el grupos atómicos:
hidroxilo: —C —OH
carbonilo: —C = O
éter: —C— O— C—;
etc.
Igualmente importante para las funciones biológicas es la fuerte tendencia del átomo de oxígeno a formar enlaces de hidrógeno no covalentes. Esto es una consecuencia de la existencia de dos orbitales sp3 llenos en el átomo de oxígeno. Incluso cuando está formando enlaces covalentes con otros átomos a través de los orbitales medio llenos, los electrones del “par solitario” en los dos orbitales sp3 restantes seguirán atrayendo fuertemente protones en otras moléculas (figura 1.2b). Estos enlaces de hidrógeno juegan un papel importante en la formación de estructuras de proteínas, ácidos nucleicos y agua.
Todas estas propiedades del oxígeno son una consecuencia inevitable de las leyes físicas de nuestro universo y la estructura subatómica del átomo de oxígeno. Como veremos la existencia de átomos de oxígeno es a su vez un resultado necesario de la evolución del universo.
3.2 La molécula de dioxígeno
Prácticamente todo el oxígeno del aire que respiramos está presente como molécula diatómica O2, que se llama correctamente dioxígeno. Se trata de una molécula extremadamente estable, en la que los átomos se mantienen unidos mediante enlaces covalentes muy fuertes. En química elemental, el enlace covalente se describe en términos de intercambio de electrones entre átomos. Esto es básicamente correcto, pero necesitamos una imagen más detallada y sofisticada para comprender las propiedades peculiares del O2. Para describir la distribución de electrones en un enlace covalente en términos de mecánica cuántica, necesitamos invocar el concepto de orbitales moleculares. Estos orbitales no solo se construyen a partir de los orbitales atómicos de los átomos involucrados, sino que también tienen en cuenta el intercambio de electrones entre socios, la esencia de un enlace covalente. Hay dos clases de tales orbitales: los que surgen de la superposición y fusión de orbitales atómicos (orbitales de enlace) y aquellos en los que los orbitales atómicos se repelen (orbitales antienlazantes). Finalmente, la geometría de los orbitales moleculares se divide en dos clases principales (para átomos pequeños). Los que se encuentran a lo largo del eje entre los dos núcleos se denominan orbitales sigma (σ), y los que están paralelos a este eje, pero fuera de este, son orbitales pi (π). Por tanto, la molécula de agua que se muestra en la figura y se mantiene unida por dos orbitales de enlace sigma formados a partir de los orbitales 1s del hidrógeno y los orbitales híbridos 2sp2 del oxígeno.
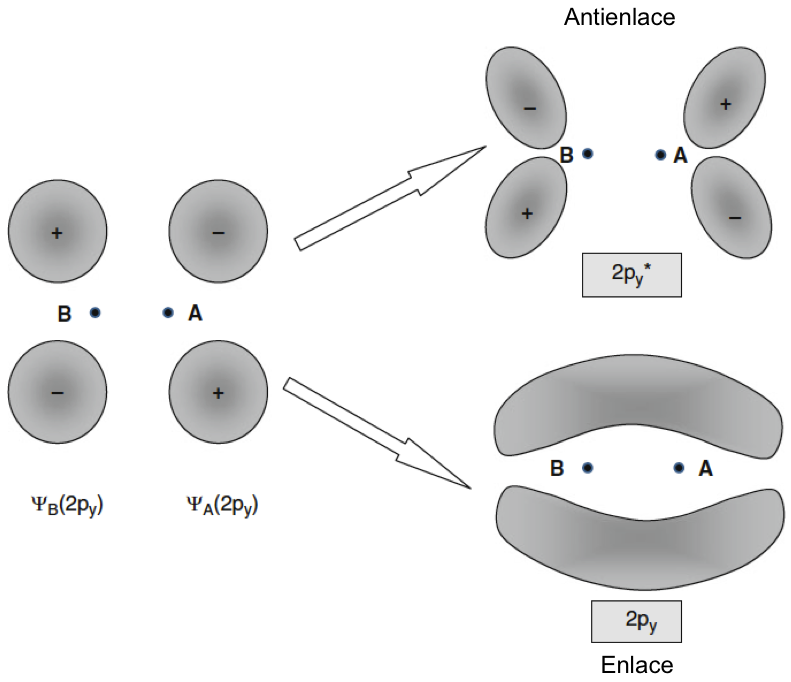
Fig. 1.3 Formación de orbitales p enlazantes y antienlazantes π. Los orbitales particulares se pueden describir mediante una función Ψ que representa la distribución de electrones en el espacio.
Con esta breve introducción podemos ver con más detalle la estructura electrónica de la molécula de O2. No hay un microscopio mágico que revele esto, más bien todo se ha deducido de muchos experimentos teóricos cuidadosos y cálculos. La imagen que surge se muestra en términos de un "diagrama de niveles de energía". Los dos átomos de oxígeno juntos transportan 16 electrones. Cuatro de ellos están en orbitales σ (1s) y, por lo tanto, no producen enlaces netos. Esto deja doce electrones en la capa exterior. Los electrones 2s forman un orbital enlazante y uno antienlazante, y por lo tanto no contribuyen al enlace neto. Dos de los electrones 2p forman un orbital de enlace σ (2px) y cuatro más forman dos orbitales de enlace π. Esto deja dos electrones más. Podrían distribuirse de varias formas, pero en el “estado fundamental” de oxígeno (el estado de energía más baja) existen sin aparear en dos orbitales π antienlazantes diferentes. Los giros pueden agregar + o - cancelar. Estas tres posibilidades (+ o -) producen un "estado triplete" para la molécula. Para enfatizar esto, a veces designaremos oxígeno molecular en su estado fundamental como 3O2. Ahora podemos calcular el número neto de electrones enlazados. En resumen: de los doce electrones p discutidos anteriormente, ocho están en orbitales de enlace, cuatro en antienlace. Esto deja un exceso neto de cuatro electrones de enlace, que corresponde a dos enlaces covalentes "clásicos", en la representación tradicional de la molécula de oxígeno como O=O.
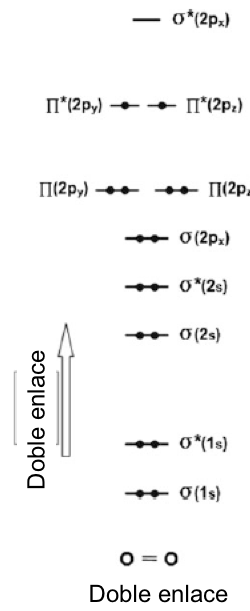
Fig. 1.4 Diagrama esquemático del nivel de energía orbital de la molécula O2 en su estado fundamental. Los niveles de energía relativa de los electrones syp se muestran esquemáticamente en el enlace y antienlace.
La existencia de dos electrones desapareados en una molécula es muy inusual y le da al oxígeno triplete algunas propiedades únicas. Por un lado, significa que el dioxígeno debe ser paramagnético y, por lo tanto, atraído por los polos de un imán. ¡De hecho, esto fue descubierto por Michael Faraday en 1845! En segundo lugar, tiende a hacer que el oxígeno en estado fundamental (triplete) sea menos reactivo de lo que cabría esperar. La razón de esto es un poco complicada. La velocidad a la que una molécula como el oxígeno puede reaccionar con otra molécula depende de la facilidad con la que se pueda formar el "estado de transición" (un estado intermedio de las dos moléculas que interactúan en el camino hacia la finalización de la reacción). El estado de transición a menudo implica que una molécula acepte temporalmente un par de electrones de la otra. Eso puede ser fácil si el estado fundamental del aceptor contiene un orbital vacío que se puede compartir temporalmente con un orbital lleno en el otro reactivo. Pero con el oxígeno triplete, los orbitales accesibles están medio llenos y ninguno puede aceptar un par de electrones. A menos que el otro reactivo también tenga un electrón desapareado (lo que dijimos que era raro), las transiciones son difíciles y las reacciones lentas. En realidad, esto es una suerte para nosotros, ya que si las reacciones con el oxígeno fueran generalmente rápidas, no estarían controladas. Nuestro metabolismo basado en el oxígeno depende del hecho de que la presencia de catalizadores favorece determinadas reacciones de oxidación deseadas, y el oxígeno no se desperdicia en un consumo infructuoso. Además, la molécula de dioxígeno puede persistir en la atmósfera durante períodos prolongados, lo que no ocurre con moléculas más reactivas como el Cl2.
Es posible, mediante la introducción de una pequeña cantidad de energía, cambiar la distribución orbital de electrones para eliminar el desapareamiento cambiando ambos electrones π * 2py a un orbital. Esto produce lo que se llama "oxígeno singlete" designado 1O2. El estado singlete tiene un espín electrónico neto cero (todos los espines están emparejados) y, por lo tanto, no es paramagnético. Además, el oxígeno singlete es altamente reactivo y rápido, porque tiene un orbital desocupado y, por lo tanto, no sufre la misma inhibición en la formación de complejos en estado de transición que el oxígeno triplete. Esto tiene consecuencias importantes cuando los seres vivos tienen que lidiar con el dioxígeno. Proporcionamos aquí una breve visión de la química de algunas formas reactivas obtenidas del dioxígeno.
3.3 Especies de oxígeno reactivas
Varios derivados de oxígeno reactivos pueden resultar de la reacción de los estados singlete y triplete del dioxígeno con ellos mismos o con otros compuestos. Solo unos pocos de estos son importantes en los sistemas vivos. Aquí se presentan brevemente sus propiedades químicas y generaciones.
Superóxido 1O2-*
El oxígeno triplete puede aceptar fácilmente un electrón que da como resultado un superóxido radical (1O2-*) con una carga negativa y un estado singlete, ya que uno de los orbitales π * 2p está ahora lleno con un par de electrones estado singlete, el asterisco "*" la propiedad del radical.
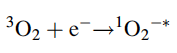
Curiosamente, Linus Pauling predijo, ya en 1931, la existencia de superóxido, basándose completamente en consideraciones de mecánica cuántica. Este radical, sin embargo, no es en sí mismo muy dañino en los sistemas biológicos y no causa mucho daño oxidativo. La principal reacción del superóxido es reaccionar consigo mismo y con el hidrógeno para producir peróxido de hidrógeno y oxígeno triplete.
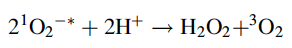
Esta dismutación de superóxido puede ocurrir espontáneamente o puede ser catalizada por la enzima superóxido dismutasa.
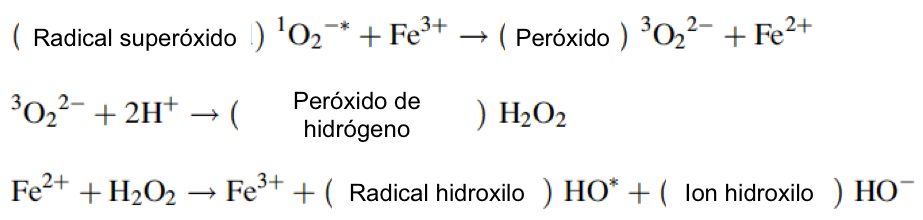
El radical hidroxilo (HO *) ahora puede reaccionar con el superóxido 1O2-* formando oxígeno singlete reactivo (1O2-*). Alternativamente, el radical hidroxilo puede reaccionar con muchas sustancias en la célula, con el consiguiente daño. Otra reacción se denomina reacción de Haber-Weiss:
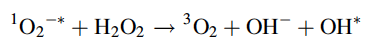
Esta reacción en cadena es biológicamente peligrosa porque es catalizada fácilmente por metales comunes y produce sustancias altamente reactivas.
Radical peroxilo (ROO *)
El radical hidroxilo altamente reactivo HO * se puede agregar a un sustrato R (por ejemplo, un compuesto de carbono) formando un radical HOR *, que también podría reaccionar con un triplete de oxígeno en el estado fundamental para producir un radical peroxilo (ROO *).
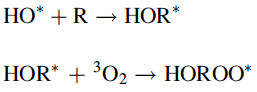
Los diversos radicales de oxígeno tienen diferentes tiempos de vida entre 10-10segundos y unos pocos segundos dependiendo de sus reactividades (Tabla 1.1). Todas estas reacciones la vida útil de los radicales: la estabilidad de las diversas especies de oxígeno puede describirse por su vida útil.


Fig. 1.5 Reacciones ROS: potenciales redox de especies de oxígeno. Se indica la reducción gradual de dioxígeno a agua.
3.4 Ozono
Existe una segunda forma molecular de oxígeno llamada ozono (O3). La molécula de ozono incluye orbitales π que se extienden sobre los tres átomos de oxígeno y orbitales de enlace σ que conectan los átomos de oxígeno adyacentes al átomo de oxígeno central. Esto también explica la forma triangular general de la molécula. El ozono se forma cuando el dioxígeno se expone a determinadas fuentes de alta energía, en particular luz ultravioleta o descargas eléctricas. Esto último explica el olor acre del ozono que notamos durante las tormentas eléctricas y alrededor de los equipos de alto voltaje. La luz ultravioleta debe tener longitudes de onda inferiores a unos 250 nm para producir ozono. Esta reacción implica primero la división de la molécula de dioxígeno en dos átomos de oxígeno; cualquiera de estos se puede agregar a una molécula de O2para formar una molécula de O3. En la naturaleza, esta reacción ocurre solo por encima de unos 20 km sobre la superficie de la Tierra. Se mide una concentración de 105-106 moléculas de ozono/cm3. En altitudes más bajas, la luz ultravioleta de onda corta del sol se filtra completamente por la absorción de O2 y, por lo tanto, no puede formar ozono.
Por lo tanto, el ozono se genera continuamente en la estratosfera. También es consumido allí por otra reacción fotoquímica impulsada por luz UV de longitud de onda más larga que escinde el O3 de nuevo en O2 + 1O1*, produciendo un radical de oxígeno en estado singlete excitado. La banda de absorción de ozono para esta división se centra en aproximadamente 255 nm. Debido a estas reacciones opuestas, el ozono en la estratosfera debería alcanzar un valor de estado estacionario que sea suficiente para evitar que mucha luz de longitudes de onda inferiores a unos 300 nm llegue a la superficie de la Tierra. Esto es una suerte para la vida, ya que la luz entre 200 y 250 nm es capaz de destruir enlaces covalentes y, por lo tanto, dañar biomoléculas esenciales. De hecho, las proteínas y los ácidos nucleicos absorben fuertemente la radiación UV en este rango de longitud de onda, con resultados muy perjudiciales. En los primeros tiempos, la vida debe haber estado confinada a las regiones del subsuelo en el mar o tierra hasta que apareció suficiente O2 en la atmósfera para generar un “escudo” de ozono.
Tenga en cuenta que la reacción de formación de ozono depende de la concentración de oxígeno. Una consecuencia es que el "escudo" de ozono se encuentra a unos 20-30 km sobre la superficie de la Tierra. En altitudes más elevadas no hay suficiente oxígeno para formar mucho ozono, y en niveles más bajos no hay suficiente luz ultravioleta de longitud de onda corta que penetre para generar mucho. Además, algo de luz de longitud de onda larga llega a elevaciones más bajas y destruye el ozono. El ozono produce un segundo tipo de efecto protector a través de la “limpieza” química de la atmósfera: el radical hidroxilo es el más importante para esto, ya que convierte muchos compuestos en formas solubles en agua, que llegarán a la Tierra en la lluvia. La reacción para la formación de HO * comienza con
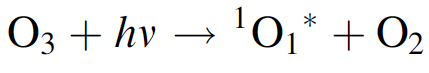
siendo 1O1 * un radical de oxígeno excitado en estado singlete. Junto con el agua, esto reacciona para formar dos radicales hidroxilo:
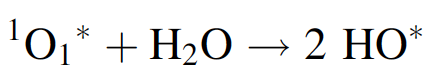
Este radical puede reaccionar con muchos contaminantes atmosféricos. Por ejemplo, con el óxido de nitrógeno NO2 produce ácido nítrico HNO3, que caerá en forma de lluvia ácida. El término "escudo de ozono" es apropiado, porque los efectos protectores son causados por una capa definida de ozono en la atmósfera.
El ozono y el oxígeno atómico son extremadamente reactivos, por lo que el escudo de ozono es muy vulnerable a las moléculas reactivas introducidas en la estratosfera. Antes de la actividad industrial humana, esto era poco común. Pero más recientemente nos hemos convertido en la fuente de daño al escudo. Los óxidos nítricos de los aviones de pasajeros, el cloro de los hidrocarburos clorados y muchas otras fuentes ahora amenazan esta protección. Afortunadamente, gracias a la cooperación internacional, el uso de hidrocarburos halogenados se ha visto muy limitado en los últimos años.
3.5 Agua
En una breve descripción de dos compuestos de oxígeno: agua y dióxido de carbono. Ambos han desempeñado un papel importante en la evolución de la vida en la Tierra. Gran parte del oxígeno de la Tierra está contenido en agua. Aproximadamente el 70% de la superficie de la Tierra está cubierta por agua y estos océanos han servido durante mucho tiempo como el principal hábitat de la vida. Los propios organismos constan de entre un 60 y un 95% de agua. Por tanto, el agua es fundamental para la vida. El agua tiene propiedades particulares e inusuales debido a la estructura electrónica especial de la molécula de agua, que a su vez es consecuencia de la estructura electrónica del oxígeno.
Esta estructura tiene una consecuencia general de que las moléculas de agua tienden a asociarse entre sí en un amplio rango de temperaturas. Por ejemplo, debido al hecho de que los orbitales sp3 llenos del oxígeno se encuentran en un lado de la molécula de agua y los dos protones están unidos al otro lado, se establece un fuerte dipolo eléctrico. Por tanto, las moléculas de agua se atraen entre sí mediante la interacción dipolo-dipolo. Aún más importante: las moléculas de agua también interactúan entre sí mediante puentes de hidrógeno más fuertes. Estos tienen una gran influencia en las propiedades del agua, ya que las moléculas de agua forman grandes grupos parpadeantes sostenidos por enlaces de hidrógeno.
Se calcula que la vida media de los grupos de agua está entre 10-10 y 10-11 s. El tamaño de estos grupos depende de la temperatura[1]. Hasta alrededor de 250 moléculas de agua están asociadas en los grupos promedio a temperaturas cercanas al punto de fusión y alrededor de 60 a 25 ºC.
Este agrupamiento explica la alta viscosidad del agua a baja temperatura y su rápida disminución al aumentar la temperatura. La menor estabilidad de las biomoléculas a temperaturas más altas también es en gran parte consecuencia de su interacción con los grupos de agua. La interacción con el agua a través de enlaces de hidrógeno es importante para la estabilización de biomoléculas como las proteínas en solución, cuando están “enmascaradas” por moléculas de agua. El agua forma capas de hidratación alrededor de las biomoléculas, estabilizando sus estructuras 3D tridimensionales. Una prueba de esto es la absorción y liberación de moléculas de agua unidas por una proteína cuando cambia entre diferentes conformaciones, como se observa, por ejemplo, cuando las hemoglobinas y hemocianinas transportadoras de oxígeno cooperativas cambian entre un estado de baja o alta afinidad[2]. Una estabilización adicional se debe al hecho de que el la cáscara de hidratación está "reticulada" por grupos. Por encima de aproximadamente 50ºC, la fluctuación térmica dificulta la formación de grupos. Como consecuencia, la estabilidad de la mayoría de las proteínas se reduce y se despliegan fácilmente en tales condiciones. A medida que se baja la temperatura, la agrupación de moléculas de agua debido a los enlaces de hidrógeno aumenta hasta que a 0ºC se forma hielo. Aquí, el tamaño del grupo es esencialmente infinito y cada molécula de agua se encuentra en el centro de un tetraedro en el que otras cuatro moléculas de agua están unidas a través de enlaces de hidrógeno. Esto es energéticamente muy favorable para el agua, pero está lejos de ser compactado. Cuando las bolas están más densamente empaquetadas, una bola se coordina con otras 12 bolas y el 74% del espacio está ocupado. Sin embargo, en el hielo, solo el 42% del volumen está ocupado por moléculas de agua. Por tanto, el hielo tiene mucho espacio vacío; de hecho, es menos denso que el agua y, por lo tanto, flota encima. Es muy inusual que la forma sólida de un compuesto sea menos densa que la forma líquida. Este comportamiento inusual también es afortunado de por vida. Si el hielo fuera más denso que el agua, los océanos y los lagos se habrían congelado hace mucho tiempo desde el fondo, dejando solo una fina banda de agua fría, incluso en los climas más cálidos. Por lo tanto, el agua con la densidad más alta a (4ºC) siempre se encontrará muy por debajo del escudo de hielo en un lago, proporcionando espacio para que los organismos sobrevivan. La congelación de organismos suele ser fatal, ya que la formación de cristales de hielo destruirá las células.
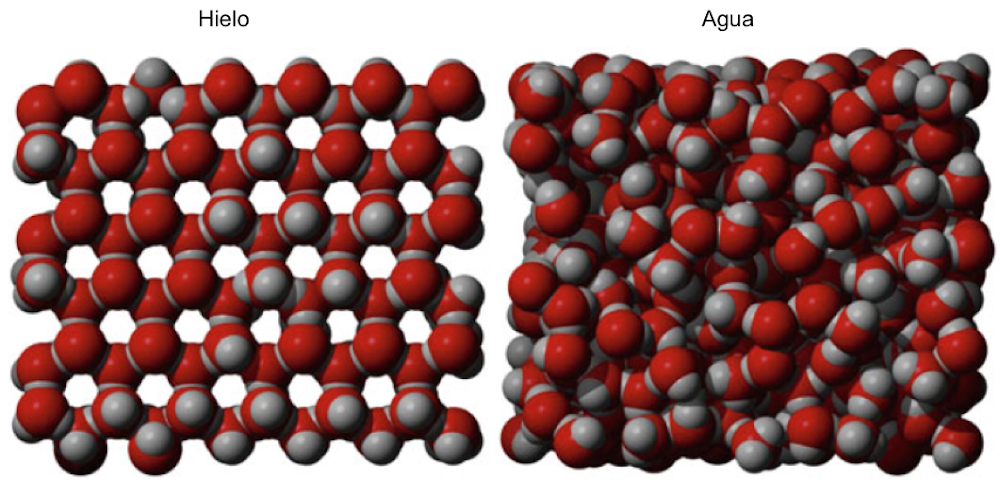
Fig. 1.8 La estructura del hielo y el agua. Los átomos de oxígeno (rojo) y el átomo de hidrógeno (gris) se dibujan como modelos de "relleno de espacio" para ilustrar cuánto espacio libre hay en el hielo entre los átomos. Tenga en cuenta que las moléculas de agua están más abarrotadas. Esto explica por qué el agua congelada necesita más volumen.
La incorporación de iones en agua o sangre tiene un gran impacto en las propiedades de los fluidos. Los iones destruyen los grupos de agua locales formando capas de agua a su alrededor. Estos grupos de iones de agua pueden estabilizar la estructura de las biomoléculas o desplegarlas.
El agua también posee otra característica importante para la vida. Cada biomolécula tiene una carga neta, algunas positivas y otras negativas, lo que debería conducir a una asociación entre tipos de carga opuestos. Con su fuerte propiedad dieléctrica, el agua es capaz de reducir la interacción electrostática entre las macromoléculas en aproximadamente 100 veces del valor que tendría en el vacío. Por lo tanto, las biomoléculas como las proteínas no se adhieren entre sí incluso cuando se encuentran en interacción con otras proteínas vecinas. Debido a la fuerte interacción entre sus moléculas, el agua tiene una gran cantidad de otras propiedades que han sido adventicias de por vida. Por ejemplo, el rango de temperatura inusualmente amplio para la estabilidad del agua líquida (0º – 100 ºC) así como la alta capacidad calorífica del agua (4,25 J g-1 K-1), han garantizado que gran parte de los océanos de la Tierra tienen líquido durante eones a pesar de las grandes variaciones de temperatura. Si no fuera así, la vida no podría haber persistido. El grado de disociación del agua en protones positivos e iones hidroxilo negativos se describe mediante el valor de pH, que es el logaritmo negativo de la concentración de protones:
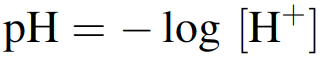
Por tanto, cuanto mayor sea el valor del pH, menor será la concentración de protones y, por tanto, el grado de disociación del agua. Este comportamiento del agua depende en gran medida de la temperatura, cuanto mayor es la temperatura menor es el pH. Dado que muchos organismos adaptan su temperatura corporal a la de su entorno, el valor del pH del cuerpo también cambiará. Para mantener el óptimo en el proceso metabólico, la naturaleza debe haber desarrollado estrategias para optimizar las propiedades de todas las biomoléculas en un organismo a pesar de tales cambios.
3.5 Vapor de agua en la atmósfera
La composición y propiedades de la atmósfera de la Tierra ha cambiado a lo largo de los tiempos geológicos. Un componente importante es el vapor de agua "disuelto" en la atmósfera. El contenido de agua en la atmósfera como vapor depende de la temperatura. Cuanto más cálida es la atmósfera, más agua se disuelve. La evidencia de grandes cantidades de agua gaseosa se puede ver en la mañana como rocío. Además, el agua atmosférica contribuye significativamente a mantener la Tierra caliente, ya que el vapor de agua es un fuerte "gas de efecto invernadero". La temperatura de la superficie de la Tierra sin atmósfera sería de unos 18ºC, pero de hecho tiene un promedio de 15ºC con su atmósfera actual.
De este aumento de temperatura, alrededor de 20,6ºC se debe al vapor de agua, 12ºC al CO2 y 0,4-2,4ºC a los gases antropogénicos de la actividad humana, que incluyen CO2, CH4, N2O, compuestos carbónicos halógenos y aerosoles. El hecho de que la cantidad de agua en la atmósfera aumente con la temperatura permite la posibilidad de un “efecto invernadero desbocado”.
3.6 Dióxido de carbono
Además del agua, un segundo compuesto de oxígeno ha jugado un papel importante, tanto en el desarrollo de la vida como en la evolución del clima de la Tierra. Este es dióxido de carbono, CO2. Es un compuesto muy estable, que implica enlaces covalentes entre el carbono (que tiene cuatro orbitales sp2 medio llenos) y el oxígeno. El dióxido de carbono es el producto principal de la oxidación completa de carbono y compuestos de carbono por oxígeno molecular. Y es uno de los constituyentes principales de la atmósfera primigenia. Es la principal fuente de carbono para los organismos fotosintéticos y un producto principal del metabolismo aeróbico. Como veremos, los niveles de CO2 en la atmósfera han variado ampliamente a lo largo de la historia de la Tierra, con efectos a menudo dramáticos.
La propiedad del CO2 que es responsable de estos efectos climáticos es su fuerte absorción en la región infrarroja del espectro. Gran parte de la energía que la Tierra recibe del sol se encuentra en la región visible y casi ultravioleta del espectro, a la que la atmósfera terrestre (incluido el CO2) es bastante transparente. A medida que esta luz solar entrante calienta la superficie de la Tierra, se vuelve a irradiar como radiación infrarroja. La mayoría de los gases de la atmósfera son transparentes a los infrarrojos, pero el CO2 no lo es, y actúa de la misma manera que un invernadero para retener energía . Este "efecto invernadero", ha tenido una profunda influencia en el clima de la Tierra a lo largo de los siglos. Cuando el CO2en la atmósfera es alto, la Tierra está caliente, y cuando es bajo, puede ser frío hasta el punto de glaciaciones globales. El ozono y el vapor de agua también son "gases de efecto invernadero".
Hay otra característica del dióxido de carbono importante para la vida. Se disuelve muy fácilmente en agua y reacciona espontáneamente para formar ácido bicarbónico (H2CO3) que se disocia en iones de hidrogenocarbonato (HCO3) casi por completo. Las reacciones, así como las cantidades relativas en equilibrio, se dan a continuación:
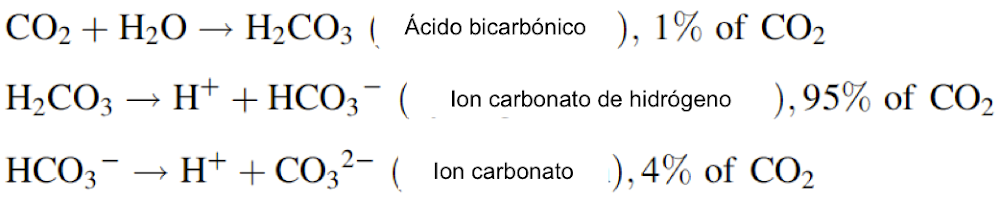
Así, el CO2 disuelto en agua actúa como un amortiguador que está presente en el océano y en la sangre de los animales. Además, el carbonato CO3-2 también es crucial para que muchos animales formen una capa protectora de carbonato de calcio.
3.7 Solubilidad de gases en agua
La disponibilidad de gases en mares y lagos depende de la solubilidad en agua. Los gases biológicamente importantes muestran diferentes solubilidades, que dependen de la temperatura. Cuanto menor es la temperatura, mayor es el contenido de oxígeno, un hecho de importancia para los animales en los mares árticos. Asumir un estado de equilibrio entre los cuerpos de agua y la atmósfera solo es válido para el primer metro de profundidad, pero los datos de equilibrio todavía dan una indicación útil del medio acuoso. El equilibrio está del lado del CO2 disuelto por un factor de 3000. Por ejemplo, una concentración de 33,4 mmol de CO2 disuelto en agua estará en equilibrio con una concentración de 0,01 mmol en aire a 25 C.
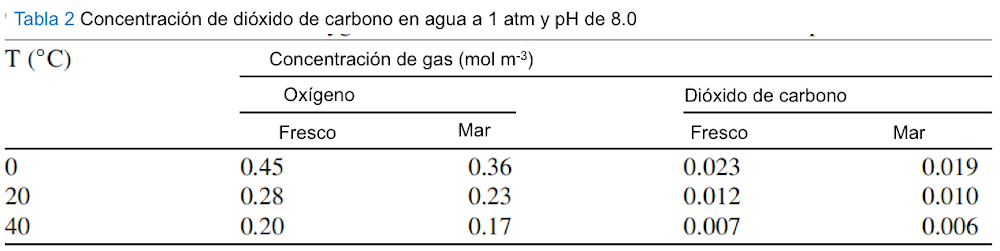
Por lo tanto, una gran cantidad de CO2 se puede disolver rápidamente en agua. Además, el CO2 se disuelve mucho mejor en agua de mar que en agua dulce. Con respecto a la distribución de gases en aguas profundas, observamos que la difusión de gases en el agua es muy baja. Por tanto, es necesaria una convección activa del agua superior con el agua inferior para proporcionar la mezcla de gas. Sin embargo, lleva mucho tiempo, unos 1.000 años mezclar los 1.000 m superiores.
3.8 Hidrólisis y deshidratación: reacciones centrales del agua en biología
En cierto sentido, el agua y sus propiedades químicas se encuentran en el corazón de las estructuras y procesos biológicos más importantes. Los principales componentes macromoleculares de todas las células son tres tipos de polímeros: polipéptidos (proteínas), polinucleótidos (ácidos nucleicos) y polisacáridos (carbohidratos). Cada uno de estos polímeros se compone de una determinada clase de monómeros.
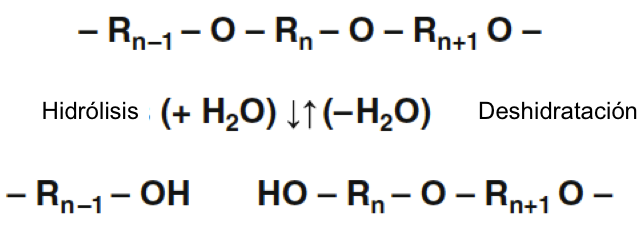
En cada caso, se puede considerar que el polímero se formó a partir de los monómeros mediante una reacción de condensación que da como resultado la eliminación de agua. Las reacciones reales in vivo son mucho más indirectas, pero el proceso general puede considerarse como la eliminación de una molécula de agua entre dos monómeros. La reacción opuesta, en la que los polímeros se descomponen en monómeros mediante la adición de moléculas de agua, se denomina hidrólisis.
Por tanto, el agua entra de forma peculiar en la formación y degradación de los principales componentes celulares. Cabe destacar que también participa en el proceso más fundamental por el cual la célula almacena y utiliza energía: la formación de ATP (trifosfato de adenosina) a partir de ADP (difosfato de adenosina).
 15.45.18.png)
La formación de ATP es básicamente una reacción de deshidratación y requiere el aporte de energía metabólica. La degradación de la hidrólisis es una forma importante de proporcionar energía para los procesos biológicos. Casi todas las fuentes de energía que puede utilizar una célula se almacenan en la reacción de deshidratación formando ATP. Casi todas las formas en que la célula usa la energía es a través de la hidrólisis de ATP. Las reacciones reales suelen ser mucho más indirectas, pero la reacción esencial es la anterior. Este papel central de la deshidratación y la hidrólisis sugiere que estos procesos se remontan al origen mismo de la vida.
3.9 Reacciones redox
Muchos procesos biológicos importantes, especialmente la generación de energía metabólica, involucran reacciones redox: procesos de oxidación y reducción. El último caso describe la ganancia de electrones por una molécula que resulta en una disminución del estado de oxidación. La oxidación es la reacción inversa que describe la pérdida de electrones por una molécula que resulta en un aumento del estado de oxidación. Así, la sustancia que pierde electrones se oxida y aumenta su número de oxidación. Esta sustancia se llama agente reductor. La sustancia que gana electrones se reduce y reduce su número de oxidación. Esta sustancia se llama agente oxidante. Por tanto, las reacciones redox se ocupan de la transferencia de electrones de un reactivo a otro. Esto también significa que cuando hay oxidación, también hay reducción.
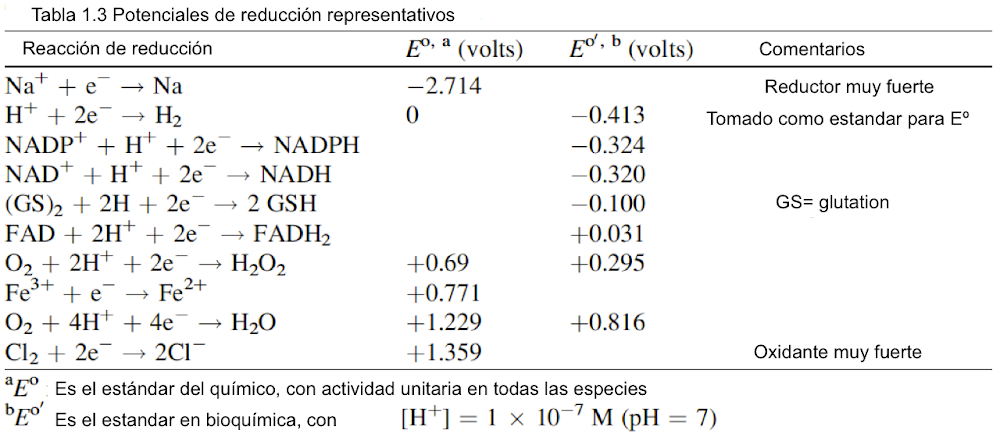
Pero, ¿qué causa estos procesos? La capacidad de oxidación y reducción se describe mediante el potencial redox dado en DEo0 (voltios). Cuanto más negativo sea el potencial redox, más fuerte será el poder de reducción. Los electrones fluyen desde un par redox de un potencial más negativo al par redox con un potencial menos negativo o incluso positivo. Tenga en cuenta que el oxígeno tiene un potencial de reducción muy alto: es un poderoso agente oxidante. La importancia biológica de las reacciones redox es almacenar y liberar energía biológica. La fotosíntesis implica la reducción del dióxido de carbono en azúcares y la oxidación del agua en oxígeno molecular.
La entrada de energía lumínica es esencial porque la oxidación del agua a O2 es muy desfavorable. La reacción inversa, la respiración, oxida los compuestos de carbono.
 15.52.32.png)
En el complejo de transferencia de protones están implicados los cofactores NAD+/ NADH (dinucleótido de nicotinamida y adenina) y NADP+/NADPH (fosfato de dinucleótido de nicotinamida y adenina). Reciclan otro cofactor, FAD +/ FADH (flavina adenina dinucleótido). El equilibrio de NAD+/ NADH y NADP+/NADPH en un sistema biológico, como una célula u órgano, describe su estado redox.
3.10 Una breve historia del oxígeno
¿De dónde vino el oxígeno? Sorprendentemente, ese átomo de oxígeno que acaba de respirar tuvo su origen en el corazón de una estrella antigua. Para entender esto, uno tiene que hacer un viaje imaginario de regreso a la creación del universo, el "big bang". Evitaremos los detalles de la física y simplemente describiremos un escenario razonable que es aceptado por la mayoría de los físicos en la actualidad. Aunque los sucesos ocurridos en los primeros minutos del universo siguen siendo muy especulativos, la mayoría de los científicos están de acuerdo con lo siguiente. Después del Big Bang, el universo se expandió exponencialmente por un factor de 10^29 en aproximadamente 10^-33 s. Estos son números inconcebiblemente grandes y pequeños (y estimaciones muy aproximadas). En ese punto, el universo contenía solo las partículas muy elementales, como gluones, leptones y quarks de los que se pueden formar todas las demás partículas, a una temperatura de aproximadamente 10^27 K. Después de 10^-6 s, el universo se había expandido y enfriado aún más a aproximadamente 10^12 K y las partículas básicas de materia (neutrones, protones y electrones) se habían formado a partir de las partículas elementales. Así, muy temprano, nació el núcleo del elemento más ligero, el hidrógeno, pero no existían otros elementos. A continuación, podría seguir la generación de otros núcleos ligeros en el plasma caliente, mediante un proceso denominado “quema de hidrógeno[3]”. Dos protones se fusionarían para formar un núcleo de deuterio, uno de los cuales se convertiría en neutrón mediante la emisión de un positrón. La colisión del deuterio con otro protón resultó en tritio (3H, un isótopo de hidrógeno con un protón y dos neutrones) o (lo que es más importante) helio 3 (un isótopo de helio con dos protones y un neutrón). Esto podría ir seguido de una fusión de dos núcleos de helio 3 para producir un núcleo de helio 4 con la liberación de dos protones. Estos protones podrían continuar el ciclo.
El núcleo de helio 4 (4He), que contiene dos protones y dos neutrones, es muy estable y fue el primer producto estable después del hidrógeno. Unos pocos 4He y 3H se fusionaron para formar 7Li. En este punto (aproximadamente 1 h después del Big Bang) la temperatura se había enfriado hasta el punto en que la combustión de hidrógeno ya no continuaba. La materia en el universo ahora consistía principalmente en algunos tipos de núcleos: alrededor del 75% de hidrógeno, 24% de 4He, 0,001% de 3He y trazas de deuterio y 7Li. Para formar átomos completos a partir de estos núcleos, la temperatura tuvo que descender a unos 3.000 K, lo que requirió unos 400.000 años. A esta temperatura, los fotones ya no tienen suficiente energía para desprender electrones (ionizar átomos) y los núcleos podrían atrapar y retener electrones para convertirse en átomos. Hasta este momento, no se había formado ninguna estrella: el universo consiste casi en su totalidad en un gas disperso de hidrógeno y 4He.
Luego, durante unos 200 millones de años (la "edad oscura del universo"), no existieron estrellas, mientras que la gravitación condensó gradualmente las grandes nubes de hidrógeno y helio. Hasta el momento, no se habían creado más elementos: con el tiempo, las nubes se contrajeron y la presión dentro de estos globos de gas aumentó a aproximadamente 200 mil millones de atmósferas, lo que también llevó la temperatura de 10-40 millones de Kelvin, lo que permitió que se reanudara la combustión del hidrógeno. A medida que las nubes se contrajeron y calentaron, se convirtieron en estrellas, que comenzaron a producir luz debido a la fusión de los núcleos de hidrógeno en helio[4]. Estas estrellas antiguas deben haber sido muy diferentes de nuestro sol. Muchos tenían masas de 100 a 1000 masas solares y consistían solo en hidrógeno y helio. Muy pocos ejemplos sobrevivientes de baja masa de tales se han encontrado antiguas estrellas de hidrógeno y helio[5]. A medida que el hidrógeno se quemaba hasta convertirse en helio, las estrellas ganaban núcleos densos en 4He. La compresión de este núcleo elevó las temperaturas a unos 200 millones de Kelvin. En este punto, se hizo posible toda una nueva serie de reacciones de fusión nuclear (denominadas "quema de helio"). Los mas importantes son:
 14.33.36.png)
y
 14.33.41.png)
El nitrógeno se puede formar en condiciones similares por el ciclo de CNO, usando 12C y 16O. La última etapa en el proceso de combustión del helio requiere temperaturas más altas que solo podrían producirse en estrellas más masivas. Estas, entonces, fueron las principales fuentes de oxígeno. En una notable coincidencia, tres de los elementos que son esenciales para la vida (12C, 16O y 15N) se sintetizaron con alto rendimiento en esta primera explosión de síntesis elemental. Con el hidrógeno ya existente, ya se había establecido gran parte de la base potencial para la vida. Las primeras estrellas que habían progresado a través de esta etapa de generación de energía encontraron uno de dos destinos, dependiendo de su masa. Aquellas menores de alrededor de 1,8 masas solares al agotarse los suministros de 1H y 4He se redujeron a enanas blancas. Las estrellas más masivas se volvieron inestables a medida que sus densos núcleos se contraían y, en la mayoría de los casos, explotaban como supernovas.
Estas supernovas son de suma importancia para nosotros, ya que las estrellas en explosión esparcieron los elementos que habían sintetizado (incluido el oxígeno) por todo el universo. Estos productos luego se incluyeron en la composición de la próxima generación de estrellas. Estos fueron capaces, a su vez, de sintetizar elementos superiores, comenzando con la mezcla rica en H, He, C, O, N con la que habían sido dotados[6]. Varios tipos de combustión dan como resultado diferentes distribuciones de elementos.
Una "quema de neón" que se produjo de manera explosiva a alrededor de 2x109 K condujo después de muchos y complejos pasos al elemento biogénico fósforo 31P. Dado que el 31P se acumula como subproducto de la combustión del neón, solo alrededor del 2,5% del importante bioelemento fósforo está presente en el universo. Las estrellas con gran masa (> 4 masas solares) eventualmente formarán centros de hierro y níquel a través de reacciones que involucran magnesio y silicio. Aunque los elementos más esenciales para la vida (C, H, O, N) son productos de las primeras etapas o nucleosíntesis estelar, otros elementos críticos como el hierro, calcio, magnesio y fósforo necesitaban estos procesos avanzados de síntesis.
Nuestro sol y nuestro sistema solar son condensados ??de una enorme nube de polvo de gas con una baja densidad inicial de aproximadamente 108-1010 partículas por m3. Esto corresponde a un vacío muy alto (uno que sería difícil de lograr incluso en el mejor laboratorio). La temperatura era de unos 15 K. La mezcla de elementos debe haberse aproximado a la composición actual del universo, aunque algo de hidrógeno y es posible que se hayan perdido otros átomos pequeños. Como consecuencia de los efectos combinados de la gravitación y la rotación, la nube de gas/polvo primitivo se contrajo en una estructura similar a un disco. En su centro estaba el sol, con el 99% de la masa total. En el disco circundante, pequeñas micropartículas se agregan a través de microaglomerados a "planetesimales", la mayoría con dimensiones de hasta unos pocos metros, pero que incluyen algunos "asteroides" más grandes[7]. Si bien el sol se formó alrededor de 8 BYA, se ha calculado que la formación principal de planetesimales es de aproximadamente 4,5 BYA. Por la colisión entre planetesimales se formaron objetos cada vez más grandes, que finalmente formaron los cuatro planetas rocosos "terrestres" compactos y densos: Mercurio, Venus, Tierra y Marte[8]. Más allá de Marte, los grandes planetas gaseosos como Júpiter y Saturno tenían suficiente gravitación como para retener hidrógeno y helio gaseosos. Presentan una composición similar al sol. Entre Marte y Júpiter hay una amplia zona, el cinturón de asteroides. Aquí circulan alrededor de 50.000 planetesimales, impedidos de formar un planeta por la fuerte influencia gravitacional del enorme Júpiter[9].
En general, se acepta que la edad de la Tierra es de unos 4.500 millones de años. Entre este tiempo y 3.8 BYA, un intervalo denominado Hadean Eon, es posible que la Tierra se haya licuado primero por el bombardeo de asteroides y luego se haya enfriado lentamente. El planeta formó una fina corteza exterior, mientras que el núcleo de hierro y níquel se separó del manto. Hay evidencia reciente de que esto puede haberse completado en aproximadamente 4,3 BYA, un período sorprendentemente corto después de la formación[10]. Sin embargo, la Tierra todavía estaba siendo bombardeada por meteoritos masivos, por lo que la superficie fue reelaborada continuamente e incluso posiblemente remodelada una o más veces. Por lo tanto, los objetos sólidos más antiguos que nos sirven para obtener información sobre el sistema solar temprano no son de la Tierra sino de meteoritos y la luna. Tanto el hidrógeno como el helio eran los elementos más abundantes en el universo y en la nebulosa solar, y debieron estar presentes como una gran fracción de ese material que pasó a formar parte de la Tierra primitiva. Hoy en día, tanto el helio como el hidrógeno libre son componentes muy pequeños de la Tierra o su atmósfera. ¿Qué pasó con estos gases? En general, se acepta que en las primeras etapas de la formación de la Tierra, el viento solar y el calor del sol eliminaron gran parte de los gases ligeros como el hidrógeno, el helio, el metano y el amoníaco[11]. Esto también es cierto para gran parte del vapor de agua que no pudo condensarse en la Tierra caliente. Por lo tanto, se retuvieron principalmente silicatos y otros minerales y la atmósfera real de la Tierra primitiva fue creada por los bombardeos de los planetesimales como se describe a continuación y la degasificación del interior[12]. La presencia actual de elementos en la Tierra como primera condensada de planetesimales no pudo haber sido sólida, pero debió haber sido fundida debido a varias fuentes de energía térmica. La radiactividad de los isótopos radiactivos de larga duración de uranio, torio y potasio (238U, 235U, 232Th y 40K) producen calor en el interior de la Tierra. La energía cinética de los planetesimales capturados contribuiría aún más al calentamiento de la superficie de la Tierra al chocar con ella. Un planetesimal con una velocidad de aproximadamente 11 km s-1 entregaría la misma cantidad de energía que la misma masa de TNT (trinitrotolueno). Sin embargo, estas fuentes no explican por sí solas el proceso de fusión. Según el modelo de agregación homogéneo, la proto-Tierra consistía en materia acumulada principalmente por hierro, níquel y silicato. A medida que la concentración de elementos pesados ??y densos como el hierro y el níquel migraron al centro de la Tierra, entregaron una enorme cantidad de energía gravitacional, lo que contribuyó al derretimiento. Como consecuencia de esto, los elementos más ligeros se encuentran hoy en el manto[13] y hierro y níquel en el núcleo.
Se cree que alrededor de 4.5 BYA la luna fue creada por la condensación de partículas que fueron expulsadas de la corteza y el manto de la Tierra por un impactador del tamaño de Marte, aproximadamente el 20% de la masa de la Tierra[14]. Esto explica por qué la luna es similar en la composición elemental a la corteza y el manto de la Tierra.
La existencia de una luna ha sido importante para la vida, ya que ralentizó el período de rotación de la Tierra de unas 6 h en la época del Hades a las 24 h de la actualidad, lo que influye en la temperatura y movimiento de las masas de agua y por tanto en la evolución de vida.
La historia de la Tierra se ha dividido en varios eones. El Hadeano abarca desde la formación de la Tierra hasta la primera evidencia posible de vida, el Arcaico desde entonces hasta la llegada del oxígeno atmosférico y el Proterozoico hasta la explosión de diversas formas animales, alrededor de 0.5 BYA. El tiempo posterior se denomina Fanerozoico.
Hoy, la atmósfera de los planeta Tierra actual tiene un 78% de N2y un 21% de O2y solo trazas de otros gases, incluido el CO2 que por efecto del hombre está aumentado rápidamente. En comparación con los otros tres planetas que se encuentran cerca del sol, esta es una excepción. Mercurio casi no tiene atmósfera, pero Venus contiene CO2 hasta más del 95% en una atmósfera densa. Marte tiene una atmósfera muy fina que contiene principalmente CO2. A excepción de la Tierra, un alto porcentaje de N2 solo se encuentra en Titán, una luna de Saturno. Como discutiremos a continuación, ahora se piensa que la atmósfera de la Tierra primitiva era cercana a la de Venus actual y ha pasado por un cambio completo.
En algún momento cerca del final del Hadeano, surgió la vida. Es probable que este no fuera un “evento puntual” que se pueda ubicar con precisión, sino más bien un proceso, repetido muchas veces y con muchos fracasos hasta que surgió una estructura autorreplicante. En cualquier caso, los primeros microfósiles potenciales, que sí son reales ya deben representar el desarrollo de estructuras autorreplicantes previamente existentes, se encuentran en aproximadamente 3.8 BYA.
Esta fecha se toma como el final del Hadeano y el comienzo del Archeaneon. Sin embargo, los microfósiles altamente acreditables solo se encuentran después de aproximadamente 3.5 BYA[15]. En ese punto, la Tierra se había estabilizado y poseía una pequeña corteza cuyo grosor era aproximadamente el 0.5% del radio de la Tierra. Como hoy, la corteza estaba formada por grandes placas flotando sobre el manto semifluido. A lo largo de las líneas de conexión entre las placas se encontraron muchos volcanes exhalando gases como CH4, H2, CO2, vapor de H2O y NH3 y pequeñas cantidades de H2S del interior de la Tierra. Estos materiales deben haber contribuido mucho a la atmósfera de la Tierra primitiva.
La atmósfera debe haber sido derivado de la nebulosa solar, como se encuentra en la atmósfera de Júpiter y Saturno, enriquecida en gases fuertemente reductores (hidrógeno, metano, amoníaco y agua). Sin embargo, las dudas se basan en dos hechos: la pequeña Tierra no pudo haber retenido hidrógeno durante un período significativo y la exhalación de los volcanes observada hoy consiste principalmente en agua y CO2. Esto también debería representar la composición de la exhalación de los volcanes en la Tierra primitiva[16]. La composición de la atmósfera dependía de si la atmósfera se estableció antes o después de la creación del núcleo rico en hierro: el contacto con el hierro metálico antes de la nucleación habría resultado en una atmósfera fuertemente reductora con CH4, H2, H2O y CO.
Después de la nucleación, el estado redox dependería de la relación Fe2+/Fe3+ y probablemente resultaría en una atmósfera reductora débil con H2O, CO2 y CO y casi sin CH4 o H2. Este es en este momento el modelo mejor aceptado para la atmósfera de la Tierra primitiva. Aunque todavía pueden liberarse en cierta medida por degasificación, los gases ligeros como el hidrógeno o el helio no permanecen en la atmósfera en cantidades significativas porque han escapado de la Tierra. La temperatura y la masa atómica determinan si una partícula puede alcanzar la velocidad de escape. La velocidad a la que las partículas dejarán la atracción gravitacional de la Tierra depende de la velocidad media de las partículas. H2 y He tienen la mayor velocidad y lo más probable es que escapen de la Tierra. Sin embargo, gran parte del hidrógeno presente en la Tierra primitiva estaba unido por el oxígeno para formar agua y también carbono y nitrógeno. Por lo tanto, casi todo He se perdió, pero gran parte del hidrógeno (en compuestos covalentes) se salvó. Así, con el tiempo, una atmósfera inicial compuesta principalmente de hidrógeno y helio libres fue reemplazada por gases más densos: principalmente N2, CO2 y vapor de agua y pequeñas cantidades de H2, NH3, CH4 y H2S liberadas por los volcanes. Esta última generación continúa incluso hoy. Por otro lado, la atmósfera de Hadean casi no contenía dioxígeno libre. Las condiciones generalmente reductoras aseguraron que incluso las pequeñas cantidades de O2 producidas por fotólisis ultravioleta de vapor de agua se reducirían inmediatamente, por ejemplo oxidando metano a CO2o amoniaco a N2.
Por lo tanto, aunque el elemento oxígeno estaba presente en abundancia, estaba casi completamente encerrado en óxidos, incluyendo óxido de hidrógeno, (agua), dióxido de carbono y dióxido de silicio. La temperatura de la superficie de la Tierra debe haber sido muy alta durante la primera parte del Hadeano, ya que la corteza se formó a pesar del continuo bombardeo de meteoritos. A medida que disminuyó el bombardeo, la corteza se enfrió, eventualmente hasta el punto en que podría existir agua líquida en la superficie. Entonces, la evaporación del agua también contribuiría al enfriamiento.
Es difícil decidir exactamente cuándo el agua, en forma de océanos o lagos, estuvo presente por primera vez en la superficie de la Tierra. Hay varios informes de estromatolitos, que se conocen hoy como esteras bacterianas formadas en aguas poco profundas con una edad de 3.5 mil millones de años. La observación de sedimentos de 3.800 millones de años da un límite superior, mientras que las rocas anteriores que podrían dar evidencia han sido altamente modificadas. ¿Cuál fue la fuente de agua fluida en la Tierra? Durante mucho tiempo se creyó que la hidrosfera fue creada exclusivamente por la actividad volcánica. Sin embargo, los argumentos de que la mayor parte del agua en los océanos tiene un origen exógeno entregado por cometas y meteoritos, ya que la Tierra misma se formó a partir de polvo de bajo contenido de agua[17]. Los cometas se componen de más del 40% de agua. En apoyo de esta idea, se determinó que la proporción de deuterio a hidrógeno en el cometa Halley era de 0.6 a 4.8 x10-4, que se encuentra en el rango de lo determinado para el agua de los océanos[18] y los meteoros. La cantidad del primer océano formado de esta manera contribuyó con el 20-70% del océano actual. Sin embargo, esta estimación es muy insegura debido a la influencia de la fotodisociación del agua inducida por los rayos UV, que produce hidrógeno que puede escapar al espacio.
El CO2 fue un componente importante de la atmósfera primitiva y jugó un papel vital en la determinación de la temperatura de la superficie. Basándose únicamente en la radiación solar, cabría esperar una Tierra primitiva fuera muy fría. El sol, 4 BYA, produjo solo alrededor del 70% de la energía radiante de hoy[19] probablemente debido a la menor proporción de He/H en el sol en ese momento. Pero un nivel alto de CO2 y CH4 en la atmósfera terrestre podría producir un fuerte efecto de "invernadero[20]". Se estima que el contenido de CO2 atmosférico era entre 100 y 1000 veces mayor en ese momento que en la actualidad[21], como resultado de la mayor actividad tectónica en la Tierra primitiva. Estos niveles se compararían con los de Venus en la actualidad. Las estimaciones son difíciles, pero muchos creen que las temperaturas promedio de aproximadamente 80 C a 4.5 BYA pueden haber sido típicas de la última parte de la era Hadeana. Posteriormente, para los arcaicos, se han calculado temperaturas que van desde más de 50 a 80 C. Es importante tener en cuenta que los extremos se encuentran por debajo del punto de ebullición del agua. Esto es muy importante para la historia posterior de la Tierra. Si los océanos hubieran hervido, poniendo toda el agua en la atmósfera, se habría producido un invernadero desbocado. Se cree que esto es lo que sucedió en Venus.
3.11 El impacto de la oxigenación en un mundo anaeróbico
En algún momento antes de 2.7 BYA, una sustancia nueva y biológicamente tóxica comenzó a aparecer en el medio ambiente. El dioxígeno producido biológicamente, O2, probablemente comenzó a acumularse en pequeños charcos o capas sobre las esteras de cianobacterias. Estos fotosintetizadores ya deben haber desarrollado formas de tratar, al menos parcialmente, el dioxígeno y, con mayor dificultad, las especies reactivas de oxígeno (ROS) derivadas de él. Pero para los anaerobios primitivos de la vecindad, estas nuevas sustancias deben haber sido especialmente tóxicas. Sin embargo, está claro que desarrollaron formas de hacer frente a las nuevas amenazas. Una forma era simplemente evitar el dioxígeno por completo. Hay evidencia de un largo período en el que el océano profundo permaneció anóxico incluso después de que el dioxígeno comenzó a acumularse en las capas superficiales y en la atmósfera[22]. Por lo tanto, los anaerobios pudieron esconderse y "ganar tiempo" para desarrollar defensas. Algunos todavía usan tales refugios hoy, en océanos y lagos profundos. La existencia en estas edades tempranas de varios sumideros químicos (como el hierro Fe2+) para el oxígeno significó que la concentración general en los océanos no se elevó a niveles significativos durante cientos de millones de años. En ese período, los organismos desarrollaron muchas y variadas formas de hacer frente a las ROS.
Producción de especies reactivas de oxígeno
Para comprender cómo los organismos aprendieron a combatir la toxicidad del dioxígeno, es necesario saber cómo se crean las ROS y qué las hace tan peligrosas. Su química básica se ha analizado, por lo que aquí enfatizaremos los aspectos biológicos. ¿Cómo da lugar el dioxígeno a ROS in vivo? el dioxígeno es paramagnético con dos electrones desapareados con espín paralelo. Esto constituye una barrera para muchas reacciones químicas. Sin embargo, el O2 se puede reducir en presencia de metales de transición paramagnéticos como el hierro y el cobre en una serie de pasos. La reducción escalonada de O2 a H2O produce varias especies reactivas que incluyen peróxido de hidrógeno (H2O2), el radical anión superóxido 1O2-* y el radical hidroxilo OH*. Los radicales hidroxilo son los más peligrosos, ya que reaccionan con casi todas las biomoléculas. Los resultados de las reacciones de OH* incluyen: modificaciones de aminoácidos como meta-tirosina y orto-tirosina de fenilalanina, inicio de la peroxidación de lípidos y oxidación de ácidos nucleicos. En las edades más tempranas de la producción de O2, las ROS probablemente se producían abióticamente en el mar mediante una variedad de reacciones adventicias catalizadas por metales. Hemos señalado que el océano primitivo anóxico debe haber sido rico en hierro ferroso, un excelente catalizador. Hay varios metales además del hierro, incluidos el cobre, el cromo, el vanadio y el cobalto que son capaces de realizar ciclos redox en los que el metal puede aceptar o donar un solo electrón. Esta acción cataliza reacciones que producen radicales reactivos. En estas reacciones, los radicales hidroxilo se producen a partir de peróxido de hidrógeno en presencia de hierro ferroso. Todas las enzimas que producen ROS o las tratan contienen uno de estos metales. Por otro lado, se han desarrollado proteínas que complejan estos metales para controlar la transferencia de carga.
Sin estas enzimas protectoras, los organismos se encontrarán con el problema conocido como "estrés oxidativo", que es un desequilibrio entre oxidantes y antioxidantes a favor de los oxidantes. Esto puede conducir potencialmente al daño de biomoléculas y, por lo tanto, ser peligroso para la vida.
En organismos superiores, sin embargo, la mayoría de los radicales libres no se obtienen del medio ambiente, sino que se crean en las mitocondrias; las plantas de energía de las células donde el dioxígeno se reduce para producir energía. Dentro de las mitocondrias, parece haber una competencia entre el útil proceso metabólico de transportar los electrones a lo largo de la cadena respiratoria o perderlos en el entorno inmediato, generando compuestos reactivos[23]. Hasta el 2% de los electrones que atraviesan la cadena respiratoria terminan formando superóxidos u otros radicales. Un punto crítico aquí es la vida útil de los radicales que forman parte de la cadena de transporte de electrones. Aquellos que son lentos en la transferencia de un electrón al siguiente paso de la cadena tienen una posibilidad significativa de transferirlo para formar un ROS.
Otro sitio de producción de radicales se encuentra en los peroxisomas, que son orgánulos especializados en la oxidación de ácidos grasos: durante la degradación de los b-lípidos, los electrones se transfieren desde un cofactor FADH2 al oxígeno molecular. Los aniones superóxido creados reaccionan para formar peróxido de hidrógeno a través de enzimas como la superóxido dismutasa (SOD). Paradójicamente, los organismos superiores parecen ser los más susceptibles a ROS. Esto ciertamente es cierto para los seres humanos. Por ejemplo, los radicales hidroxilo tienen un papel importante en las arteriosclerosis al destruir las lipoproteínas y el tejido endotelial[24]. Pero los radicales hidroxilo también pueden causar daño debido a la peroxidación de lípidos de las membranas. Curiosamente, solo los ácidos grasos insaturados experimentan peroxidación de lípidos, mientras que las grasas saturadas no. Por otro lado, también debe tenerse en cuenta que se necesita dioxígeno para sintetizar ácidos grasos insaturados, comúnmente conocidos como los ácidos grasos "buenos". ¿Por qué es tan importante tener ácidos grasos insaturados? Lo más probable es que establezcan las propiedades particulares de las membranas: la fluidez y la permeabilidad de varios sustratos en contraste con las membranas rígidas hechas de ácidos grasos saturados.
No solo las macromoléculas, sino también los cofactores, como el importante reductor metabólico NADPH, son vulnerables a las ROS. Por ejemplo, el oxígeno singlete reacciona muy rápidamente con NADPH dando como resultado peróxido de hidrógeno y NADP[25]+. Hemos introducido algunas reacciones muy importantes mediante las cuales se crean ROS y de qué manera atacan objetivos biológicos. Hay varias otras vías para producir ROS en cantidades más pequeñas: vía xantina oxidasa, NADPH oxidasas, citocromos P450 y monoxigenasa oxidasas. La creación de ROS no se limita a los animales, sino que también ocurre en las plantas. Durante la transferencia de electrones de alta energía dentro del proceso fotosintético, algunos electrones pueden escapar de la cadena para producir ROS[26]. Aquí, se desarrolló una clase de antioxidantes que solo se encuentran en las plantas, una clase especial de carotenoides, para brindar protección.
A pesar de su naturaleza deletérea, las ROS en concentraciones fisiológicas se han vuelto importantes para la vida. A través de la evolución, los organismos han aprendido a utilizarlos para la transmisión de señales intra e intercelulares y la regulación de los estados redox celulares.
El hecho notable es que durante la evolución, los organismos superiores se volvieron dependientes de ROS. ROS comenzó a desempeñar un papel importante en la señalización celular. Por tanto, para mantener una homeostasis celular adecuada, se debe mantener un equilibrio entre la producción y el consumo de ROS.
Los problemas que los anaerobios y aerobios tienen con ROS son fundamentalmente diferentes. Parece que la vida anaeróbica temprana en la Tierra tuvo que hacer frente a las ROS creadas en el medio ambiente; ya sea por fotólisis inorgánica o fotosintezizantes emergentes, mientras que los aerobios han tenido que lidiar principalmente con las ROS autogeneradas. La utilización de dioxígeno puede proporcionar mucha energía, pero también conlleva un peligro considerable. Se desarrollaron diferentes estrategias en forma de enzimas y compuestos químicos para reducir este peligro.
La mayor parte de la vida en la Tierra con la que estamos familiarizados evolucionó en presencia de dioxígeno y tuvo que adaptarse a esta sustancia potencialmente peligrosa. Esto se logró mediante la evolución de una gran batería de sistemas antioxidantes. Algunos de estos sistemas están presentes en todas las formas de vida, desde las bacterias hasta los mamíferos, lo que indica la aparición de al menos rastros de dioxígeno al principio de la historia de la vida. De hecho, es posible que el oxígeno generado fotosintéticamente haya aparecido en sitios locales mucho antes del primer aumento notable del dioxígeno atmosférico de aproximadamente 2.5 BYA (BYA es una abreviatura de "hace mil millones de años”). Incluso antes, deben haber estado presentes trazas de dioxígeno generadas por la fotólisis inorgánica del agua. Aquí nos concentraremos en algunos sistemas antioxidantes y sus funciones. Hay dos tipos de antioxidantes: moléculas pequeñas que eliminan el oxígeno al reaccionar con ROS y sistemas enzimáticos que los desintoxican. También existen sistemas que combinan moléculas pequeñas y enzimas específicas.
Ya hemos enfatizado los peligros que la llegada del dioxígeno presentó a los organismos anaeróbicos existentes y las formas en que evolucionaron para hacer frente a los problemas. Sin embargo, esto es solo una parte de la historia y si hubiera terminado aquí, nosotros y el mundo que conocemos no existiríamos. En cambio, lo que sucedió fue bastante notable; porque la vida aprovechó la oportunidad que presenta la presencia de dioxígeno libre para volverse muchas veces más eficiente en la extracción de energía de los alimentos. Como veremos, este metabolismo aerobio y oxidativo abrió a su vez multitud de nuevas oportunidades de crecimiento y diversificación. Omitiendo una gran cantidad de bioquímica complicada, podemos explicar la ventaja del metabolismo oxidativo sobre el metabolismo anaeróbico de una manera muy simple. Lo que cuenta en la generación de energía metabólica es la cantidad de energía libre que se puede extraer procesando una sola molécula de alimento. La producción de energía efectiva se mide más directamente en términos de cuántas moléculas de ADP se convierten en ATP por molécula de nutriente, porque el ATP es la moneda de energía universal, que se utiliza para impulsar todo tipo de proceso celular. Considere ahora un proceso de fermentación anaeróbico que utiliza glucosa (C6H12O6) como alimento. Una reacción general típica se puede escribir como:
glucosa + 2 ADP + 2 fosfato -> 2 ácido láctico + 2 ATP
En resumen, se obtienen dos ATP por glucosa fermentada. Ahora considere la misma molécula de glucosa, pasando por el metabolismo oxidativo de una célula aeróbica típica: la reacción general (que en realidad involucra muchos pasos intermedios), se puede resumir como
glucosa + 6 O2 + 38 fosfato + 38 ADP -> 6 CO2 + 38 ATP + 6 H2O
La energía (ATP) obtenida al oxidar completamente la glucosa a CO2 y agua es 19 veces mayor que en el proceso anaeróbico. Los organismos no podrían cosechar esta recompensa de energía hasta que el dioxígeno libre estuviera disponible en la Tierra. Así, la llegada del dioxígeno fue, de hecho, una enorme bonanza para la vida. El proceso real de extraer esta energía del metabolismo aeróbico no es de ninguna manera tan simple y directo como implicaría la ecuación que hemos escrito. Se requieren un complejo aparato molecular y una elaborada serie de reacciones. No estamos interesados ??aquí en todos los detalles, pero debemos ilustrar algunos de los mecanismo, para preguntar: ¿cómo pudo haber evolucionado este nuevo metabolismo?
La entrada del dioxígeno al metabolismo, en los procesos de liberación de energía, requiere que haya algo que oxidar, es decir, una molécula o moléculas que puedan transferir electrones al oxígeno para reducirlo a H2O. La sustancia que desempeña el papel principal como agente reductor es el dinucleótido de nicotinamida y adenina reducido, abreviado NADH; su oxidación y reducción. El NADH y su forma oxidada, NAD+, pueden haber sido participantes muy antiguos en el metabolismo como portadores de electrones. También son esenciales en la fermentación, y muchos incluso se han producido abióticamente en el momento del origen de la vida[27].
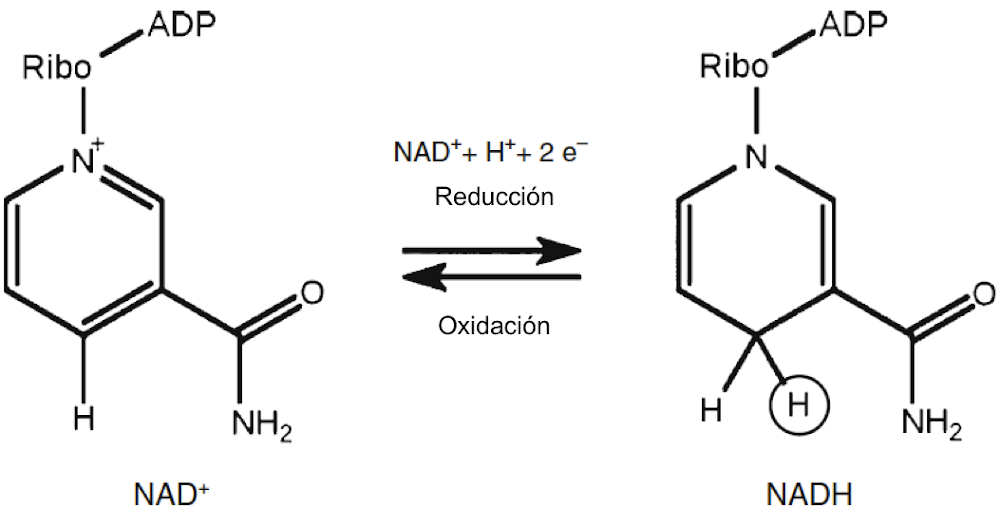
El metabolismo aeróbico de una sustancia como la glucosa avanza primero a través del ciclo del ácido cítrico en el que el carbohidrato finalmente se oxida completamente a CO2. Los electrones se transfieren a una gran cantidad de moléculas de NAD+, reduciéndolas a NADH. Estos luego pasan a través de la cadena de transporte de electrones donde finalmente ceden electrones al oxígeno, produciendo agua. La cadena de transporte de electrones se encuentra en bacterias aeróbicas y en mitocondrias, organelos celulares especiales de organismos superiores. El transporte de electrones a través del sistema impulsa el bombeo de protones a través de la membrana mitocondrial. Esto crea un gradiente de pH y una fuerte fuerza impulsora para recuperar los protones. Pero los protones solo pueden volver a entrar en la matriz mitocondrial a través de un "generador de ATP"; es aquí donde se produce la mayor parte del ATP. Esta forma de generar ATP a partir de ADP se denomina fosforilación oxidativa.
¿Cómo evolucionó un mecanismo tan complejo y aparentemente extraño? Ciertamente, todavía no podemos recrear el camino, pero hay ciertas pistas. Recuerde que debe haber existido previamente otro sistema complejo de transducción de energía: los fotosistemas que llevaron a cabo la fotosíntesis oxigenada. Estos deben haber sido completamente funcionales y bien evolucionados antes de que pudiera desarrollarse la generación de ATP aeróbico; porque no habría tenido sentido tener un sistema que utiliza oxígeno antes de que el medio ambiente fuera provisto de dioxígeno.
¿Podría el sistema mitocondrial (en su forma bacteriana más primitiva) haber evolucionado a partir del aparato fotosintético? Ciertamente son muy diferentes, pero aparecen algunas similitudes sorprendentes si comparamos los flujos de electrones en las mitocondrias y los cloroplastos. Si imaginamos el fotosistema con el flujo de electrones invertido, la similitud se vuelve intrigante. ¿Podría haber habido un período en la evolución en el que algún tipo de microbio podría fijar carbono y liberar oxígeno cuando está bajo la luz del sol mediante la fotosíntesis, y luego "invertir su motor" para quemar carbohidratos con dioxígeno en períodos de oscuridad? Hoy, por supuesto, la mayoría de las plantas tienen tanto cloroplastos como mitocondrias, y los utilizan para procesos separados. Una explicación alternativa (¿o complementaria?) Radica en la similitud de las “bombas de protones” que se utilizan para eliminar de la célula los protones que se acumulan en el metabolismo anaeróbico al “generador de ATP” que funciona en sentido contrario durante la fosforilación oxidativa.
Si la descripción del aumento de dioxígeno, es correcta, parecería razonable que el metabolismo aeróbico, expresado primero en bacterias, probablemente no sea anterior a 2.2 BYA. Lo más probable es que los primeros fueran aerobios facultativos, que recurrirían al metabolismo anaeróbico en las situaciones frecuentes en las que no había dioxígeno. Tal organismo habría sido útil para los sensores de oxígeno. Cabe señalar que incluso los aerobios como nosotros pueden llevar a cabo la generación de ATP anaeróbico en músculos que se han quedado sin oxígeno por ejercicios vigorosos.
Hay quienes, sin embargo, enfatizan la evidencia genética molecular de la antigüedad de ciertas enzimas de la cadena respiratoria. Argumentan que el metabolismo oxidativo es anterior al aumento del dioxígeno atmosférico[28]. Sin embargo, esta no es la opinión generalmente aceptada, ya que la ventaja selectiva de poseer un metabolismo oxidativo en la virtual ausencia de dioxígeno es difícil de ver. Sin embargo, uno debe recordar que la primera aparición de la fotosíntesis oxigenada puede haber sido anterior al "Gran Evento de Oxidación". Los microbios que desarrollaron dioxígeno también pueden haber aprendido a usarlo en una etapa muy temprana, extrayéndolo de su entorno local rico en oxígeno.
De hecho, puede ser que sea imposible siquiera definir el "primer aerobio". No es probable que la adquisición del complejo conjunto de vías metabólicas que consideramos características de los aerobios existentes (el ciclo del ácido cítrico, la fosforilación oxidativa, etc.) haya evolucionado en un solo paquete ordenado. Más bien, debe haber existido estados intermedios de evolución, incluidos organismos extintos hace mucho tiempo que tenían una funcionalidad aeróbica parcial o limitada. La implicación de los datos sobre la evolución de las proteínas es un aumento gradual de la complejidad metabólica. Pero hubo mucho tiempo. Han transcurrido por lo menos 500 millones de años desde el gran evento de oxidación hasta la aparición incluso del antepasado más antiguo de los organismos modernos. Aunque es imposible establecer una fecha precisa o incluso un período para los primeros aerobios, ciertamente debe ser anterior a la evolución de los eucariotas, que se fecha entre 1.8 y 0.8 BYA. Una discusión reflexiva de lo posible.
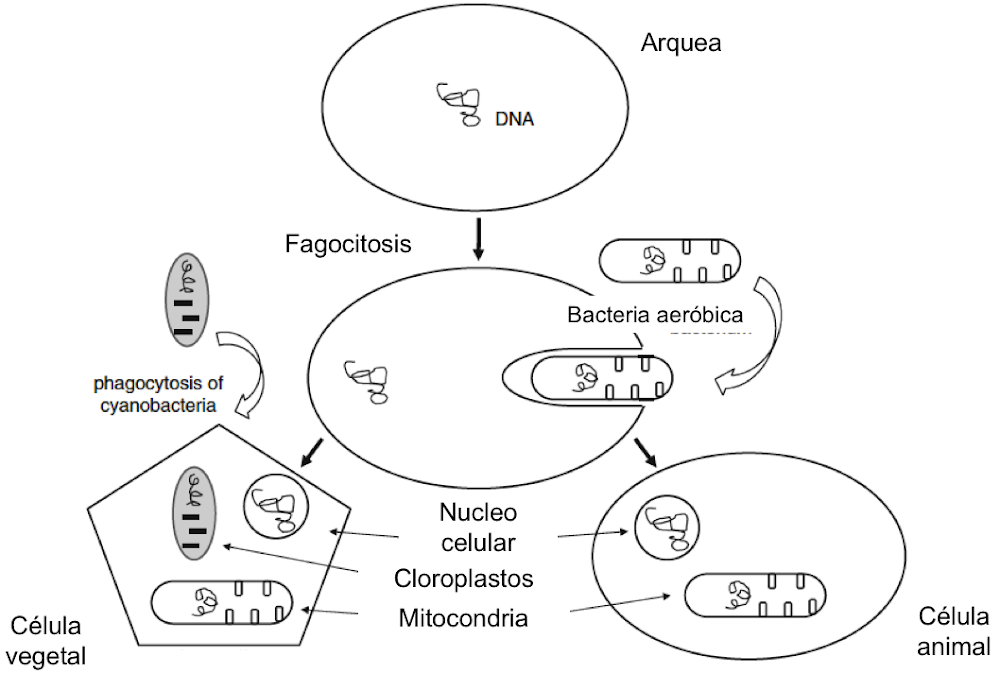
3.12 Distinción entre procariotas y eucariotas
Parece probable que los primeros fotosintetizadores y los primeros aerobios fueran miembros procariotas del reino ahora conocido como Eubacteria. Estos antiguos linajes se caracterizan por la falta de orgánulos internos. Por ejemplo, no tienen un núcleo en el que su ADN esté separado del citoplasma. Una célula eucariota, como la que se encuentra en todos los protozoos, algas, plantas superiores y animales, se caracteriza por la presencia de un núcleo, separado del citoplasma por una membrana nuclear, más (generalmente) mitocondrias, y en algunos casos (plantas y algas) cloroplastos también. Algunos procariotas aeróbicos parecen mitocondrias libres; algunas bacterias fotosintetizadoras parecen cloroplastos individuales.
3.13 La hipótesis simbiótica
Si examinamos los cloroplastos y las mitocondrias más de cerca, encontramos una fuerte evidencia de su ascendencia procariota. Por ejemplo, cada uno de estos orgánulos tiene su propio ADN, que codifica algunas pero no todas sus proteínas. La organización estructural de este ADN es mucho más parecida a la de las bacterias que al ADN nuclear que se encuentra en las mismas células. La maquinaria de síntesis de proteínas de los cloroplastos y las mitocondrias se parece mucho a la que se encuentra en los procariotas y es diferente a la del citoplasma de la célula eucariota. Además, algunas enzimas mitocondriales parecen estar relacionadas con las de los procariotas, más que con sus homólogas en el citoplasma eucariota. Todas estas similitudes son consistentes con las propuestas hechas hace más de 100 años y elaboradas y refinadas que las células eucariotas surgieron por la absorción simbiótica de bacterias aeróbicas por una célula "huésped". En las plantas, se postula una simbiosis similar con las bacterias fotosintéticas por las células primitivas nucleadas. Estas propuestas son ahora ampliamente aceptadas, aunque se han planteado preguntas en los últimos años[29]. El proceso puede continuar, con simbiosis de bacterias metabolizadoras de sulfuros en moluscos y anélidos cerca de los respiraderos hidrotermales[30]. Aún más sugerente es el informe de que las babosas marinas que albergan algas fotosintéticas han experimentado una transferencia genética nuclear de genes de fotosíntesis[31]. Cabe señalar que existen discusiones sobre eucariotas sin mitocondrias, pero que tienen un núcleo, siendo la base del phyla de eucariotas[32].
La evolución de los eucariotas supuso un gran avance, pues una célula con núcleo, capaz en principio de mitosis y reproducción sexual, y provista además por sus mitocondrias de una fuente interna de abundante ATP, poseía enormes ventajas competitivas. Las fechas son inciertas. Los primeros fósiles que podrían considerarse protozoarios eucariotas datan de 1.5-1.8 BYA[33]. Sin embargo, algunos argumentan que era más probable que fueran procariotas avanzados y que el origen de los eucariotas se encuentra más cerca de 1.0-0.9 BYA[34]. En aparente contraste está la Grypania fósil de 1.8 MYA, un organismo en espiral de medio metro de largo identificado tentativamente como un alga. Si Grypania se ha identificado correctamente, el origen de los eucariotas debe estar cerca de la fecha anterior propuesta por Knoll. El problema, por supuesto, está en reconocer suficientes detalles internos en los fósiles antiguos para sacar una conclusión definitiva. Para complicar la pregunta, las estimaciones del reloj molecular sugieren aproximadamente 2 BYA. Queda mucha discusión, pero probablemente la mayoría estaría de acuerdo en que alrededor de 1,5 BYA existían verdaderos eucariotas.
En algún momento antes de 1.0 BYA, surgieron los primeros organismos multicelulares (metazoos). La evidencia más temprana es de formas similares a hojas que pueden representar algas multicelulares que se encuentran ya en 1.7 BYA[35]. Se observan algas más definitivas en aproximadamente 1,2 BYA[36]. A partir de esta fecha, existen múltiples "fósiles" pequeños, generalmente de filogenia no identificada. La evidencia definitiva de las esponjas primitivas se encuentra mucho antes de 600 MYA; estos probablemente representan los primeros organismos multicelulares que pueden estar claramente relacionados con especies vivas. Sin embargo, Müller, argumentan que los primeros metazoos debieron haber evolucionado mucho antes[37]. La aparición de tales organismos multicelulares con macroestructura discreta, que implica el desarrollo de tipos de células especializadas, representa un avance importante en la evolución animal. Requiere, en particular, un mecanismo para la expresión específica (o no expresión) de algunos genes en células diferenciadas. Debido a que cada célula de un organismo determinado contiene el mismo ADN y un conjunto completo de genes, la regulación genética específica fue la clave para la multicelularidad.
La existencia de múltiples tipos de células especializadas, así como un tamaño más grande, le da a los metazoos ventajas sobre los protozoos tanto para obtener alimento como para resistir la depredación. Qué nivel de depredación existió 1 BYA es completamente desconocido; al menos debe haber existido entre los protistas. Por lo tanto, una criatura multicelular ganó una defensa intrínseca y, al mismo tiempo, distintas ventajas en la búsqueda de presas protozoarias y procariotas. Hemos mencionado que la melanización, que podría haber ocurrido en las células dérmicas de los metazoos primitivos, podría ofrecer protección contra ROS; también podría haber formado una cutícula defensiva contra la depredación. Una vez que se estableció el principio de especialización celular, se abrió el camino para vías casi infinitas de desarrollo de órganos especiales, funciones y diversidad animal.
¿Cómo se originó la multicelularidad? Aunque prácticamente no tenemos evidencia, no hay escasez de especulaciones[38]. Existen tres modelos principales:
(a) Colonias de división: formadas por división celular múltiple sin separación celular.
(b) Células multinucleadas: Formadas por división nuclear sin división celular. Estas células se conocen incluso hoy, por ejemplo, en larvas de Drosophila. Se necesitaría una etapa posterior de segregación para producir una verdadera multicelularidad.
(c) Asociación celular: esto se ve hoy como ciertos mohos limosos que existen tanto en etapas unicelulares como multicelulares.
Realmente no hay evidencia para elegir entre esos u otros modelos. Pero es obvio que existen múltiples posibilidades. Para el desarrollo de la especialización celular, se necesitaba un mecanismo que proporcionara un control diferencial de la expresión génica entre células con genomas idénticos. En la actualidad, esto se logra en todos los metazoos mediante la complejación del ADN genómico con histonas y proteínas no histonas para formar cromatina. Este complejo facilita la expresión selectiva de regiones específicas del genoma. Por tanto, es una hipótesis razonable que el desarrollo de metazoos diferenciados dependiera de la evolución del núcleo eucariota y de su ultraestructura moderna. En algún momento de la transición de procariotas a metazoos, debe haber surgido un nuevo mecanismo de regulación genética que involucra la estructura de la cromatina y su dinámica. Pero tenemos muy poca idea de cuándo sucedió esto.
¿Qué mantiene unidas las células de un metazoo? En los que vemos hoy, esto se logra mediante una matriz extracelular compuesta por una variedad de proteínas fibrosas. El principal de ellos es el colágeno, formado por cadenas polipeptídicas extremadamente largas ricas en glicina, prolina e hidroxiprolina. El último aminoácido es inusual; no está codificado en el genoma, sino que se forma a partir de residuos de prolina en las fibras de colágeno mediante una reacción inusual. El dioxígeno es absolutamente necesario para este paso en la formación de fibrillas de colágeno maduras. Sorprendentemente, el ácido ascórbico también es esencial, y esta es una de las pocas funciones coenzimáticas conocidas del ácido ascórbico en los animales, mientras que en las plantas, especialmente en los cloroplastos, hay muchas. Todo el proceso se parece mucho al tipo de proceso acoplado enzima/eliminador.
También se necesita notablemente dioxígeno para otro paso en la maduración del colágeno: la formación de enlaces cruzados entre las fibrillas. Así, el colágeno en su forma funcional en la matriz no podría haber existido en un mundo anóxico, y el advenimiento del dioxígeno parecería necesario para el desarrollo de los metazoos, al menos tal como los conocemos.
Hay otra biomolécula importante que necesita dioxígeno para la síntesis: la colesterina. Esto es necesario para hacer que las membranas celulares sean más rígidas. Sin embargo, la colesterina solo puede ocurrir después de que se dispuso de dioxígeno para convertir el escualeno biogénico en colesterina.
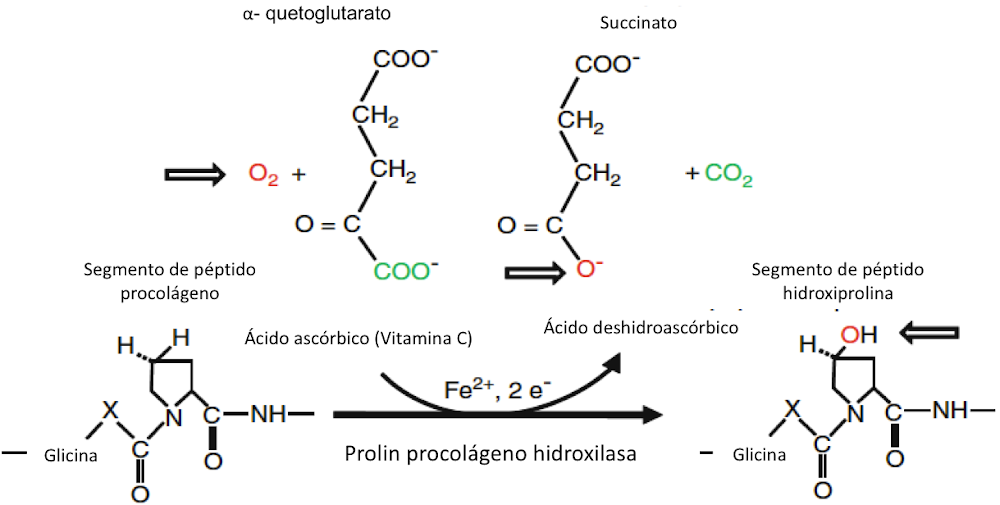
En resumen, el aumento de dioxígeno que se produjo durante el Proterozoico medio permitió primero el desarrollo del metabolismo aeróbico en determinadas bacterias. Estos, probablemente por simbiosis con otras bacterias, dan lugar a los primeros eucariotas: protistas portadores de mitocondrias y algas. Esto, a su vez, a medida que aumentaban los niveles de dioxígeno, permitió el ensamblaje de estructuras multicelulares, los metazoos.
Hacia el final del Proterozoico, alrededor de 575 millones de años, encontramos la evidencia de un grupo de animales grandes y de cuerpo blando que no pueden relacionarse claramente con ninguna criatura existente antes o después. Se trata de la fauna de Ediacara, llamada así por el lugar en Australia donde se encontraron por primera vez tales fósiles. En la figura siguiente se muestra un ejemplo. Fedonkin (1994) ofrece una descripción general. Los ediacaranos eran criaturas aplanadas casi universalmente delgadas (1–2 mm) que se reclinaban sobre sedimentos o se proyectaban desde ellos como abanicos de mar modernos[39]. Algunos podrían ser bastante grandes: los especímenes de Dickinsonia se han acercado a 1 m en dimensión máxima.
 15.47.40.png)
Fósil de Dickinsonia costata
 15.47.47.png)
Depredador temprano del cambrium Anomalocaris canadensis
No hay evidencia clara de una boca, ano, sistema digestivo o sistema circulatorio, lo que implica que los ediacaranos pueden haber ingerido nutrientes y dioxígeno directamente a través de sus superficies; tal vez por eso eran tan delgados. Los ediacaranos desaparecieron casi tan repentinamente como aparecieron, alrededor de 550 MYA, al final del precámbrico. Este fue el período de una gran explosión de especies protegidas por conchas y caparazones. Esto sugiere el advenimiento de la megapredación y, de hecho, existe evidencia de grandes depredadores al principio del Cámbrico. Los ediacaranos delgados, de cuerpo blando y inmóviles habrían sido presa fácil de cualquier depredador, sin importar cuán ineficaces fueran. Por lo tanto, su rápida desaparición probablemente no sea sorprendente. Sin embargo, es sorprendente que no haya surgido ninguna evidencia clara de la depredación de los habitantes de Ediacara. Quizás su extinción fue muy rápida, una vez que aparecieron los depredadores. McMenamin (2003) ha estimado que la depredación, una vez introducida, podría abarcar el mundo en unos pocos millones de años[40].
Una característica que comparten casi todos los animales superiores, incluidos todos los vertebrados, moluscos y artrópodos, es un plan corporal bilateral. Esto se refiere a la pseudosimetría de un número par de piernas, ojos, etc. en un plano de reflexión.
Decimos pseudosimetría porque no es exacto; tenemos un solo corazón, por ejemplo, y está en un lado.
Ahora se reconoce que la clave de la bilateridad radica en la expresión regulada de ciertos genes durante el desarrollo embrionario. ¿Qué tan temprano evolucionó el plan bilateral? Está claramente presente en muchos de los phyla que se reconocen temprano en el Cámbrico, pero no es obvio que los Ediacarans de cuerpo blando fueran verdaderos bilaterios.
Por esta razón, el descubrimiento en estratos de 580–600 MYA en China, de un fósil muy pequeño, pero claramente bilateral, fue de gran importancia[41]. El fósil llamado Vernamimalcula tiene una ultraestructura compleja, que muestra evidencia de una historia evolutiva sofisticada. Aunque probablemente sea contemporáneo o ligeramente anterior a los ediacaranos, Vernamimalcula, claramente no está relacionado con ellos y es más probable que esté en la línea de descendencia que condujo a uno de los principales filos existentes. Hacia 555 MYA, todavía precámbrico, existían algunos animales grandes bilaterales que tenían partes rígidas como la Kimberella quadrata que se encuentra en Australia y Rusia[42].
Una mirada a largo plazo sobre el registro fósil revela una verdadera discontinuidad en aproximadamente 545 millones de años al comienzo del Cámbrico. Antes de esta fecha, los fósiles son escasos y los fósiles con evidencia de conchas, esqueletos u otras partes duras son casi inexistentes.
Antes de esta fecha, es difícil reconocer organismos que puedan identificarse claramente como antepasados ??de cualquier especie viva. Aparte de las esponjas, mencionadas anteriormente, la única excepción puede ser la Kimberella, similar a un molusco. Por otro lado, poco después del comienzo del Cámbrico, se representan la mayoría de los filos existentes.
Esta aparente diversificación repentina de especies se ha denominado la "explosión cámbrica", y fue un enigma incluso para Darwin[43]. Después de muchos años de debate, la opinión científica todavía está dividida entre aquellos que toman la explosión literalmente y creen que todos los principales phyla surgieron en un período relativamente corto, alrededor de 550 MYA, y aquellos que creen que existieron antecedentes específicos de la mayoría de los phyla, mucho más temprano. Estos últimos tienen que explicar la falta de fósiles. Hay dos intentos de explicación comunes:
(a) Quizás el antepasado de los moluscos, artrópodos, anélidos, etc., era de cuerpo blando y no se conservaba bien. Sin embargo, la preservación de la fauna de Ediacara parece contradecir este argumento.
(b) Quizás todos los predecesores eran muy pequeños y, por lo tanto, sus fósiles han escapado a la detección. Esto también es difícil de aceptar, considerando la gran cantidad de fósiles pequeños o incluso microscópicos de protistas y procariotas que han sido reconocidos, incluso desde los arcaicos.
En contraste con estos argumentos, la mayoría de los datos del "reloj molecular" del análisis de secuencias de ARN o proteínas apuntan a fechas mucho más tempranas (800-1,200 MYA) para la divergencia de los principales phyla eucariotas[44]. Hay otra lógica en este punto de vista. Cada uno de los filos existentes posee estructuras particulares y complejas. Es difícil ver cómo todos estos podrían haber surgido simultáneamente de algún antepasado generalizado en el breve período en el límite del Cámbrico. Más bien, uno esperaría que la evolución de sus características únicas debe haber tenido sus raíces en períodos anteriores. Por ejemplo, moluscos y artrópodos desarrollaron químicas completamente diferentes para construir conchas y caparazones, para la misma función protectora. Estos organismos deben tener previamente desarrollaron sus diferentes proteínas transportadoras de oxígeno (OTP) para permitir la existencia de dicha estructura. Como veremos más adelante, las OTP de moluscos y artrópodos son diferentes y aparentemente evolucionaron a partir de diferentes proteínas con diferentes funciones. Esto sostiene que los ancestros comunes existieron mucho antes.
A pesar de las fuertes afirmaciones en sentido contrario, no nos parece que la controversia sobre la "Explosión Cámbrica" ??esté todavía reconciliada, o lo estará en un futuro próximo. Una característica clara del Cámbrico temprano es la aparición bastante repentina de esqueletización, caracterizada especialmente por las conchas de los moluscos, los exoesqueletos de los artrópodos y la cutícula de los anélidos. Por varios medios diferentes, los animales se estaban blindando de repente. Estas criaturas están enmarcado contraste con el ediacárico de cuerpo blando, pronto marcado para la destrucción. La explicación más simple para esto es la defensa contra los depredadores. De hecho, hay evidencia de que la macropredación se volvió significativa aproximadamente en este momento. El artrópodo primitivo Anomalocaris que se encuentra entre 540 y 500 MYA debe haber sido un depredador formidable incluso para presas importantes.
Pero esto plantea otra pregunta: ¿Por qué las criaturas de repente se volvieron grandes? Podemos sugerir lo siguiente: solo aproximadamente en este momento los niveles de dioxígeno finalmente aumentaron hasta cerca del valor actual. Como veremos en el próximo capítulo, los niveles bajos de dioxígeno causan dificultades a los animales grandes y restringen el aumento de tamaño a menos que se tomen disposiciones especiales para suministrar dioxígeno a los tejidos. Esto es especialmente cierto para el organismo blindado contra los depredadores. El dioxígeno puede haber jugado, por una vez más, un papel crítico en la evolución.
3.14 ¿Cómo administrar dioxígeno a los tejidos animales?
La cantidad de dioxígeno que necesita un organismo para el metabolismo aeróbico depende de muchos factores, siendo el tamaño y la actividad los más importantes. Sin embargo, como una cifra aproximada, podemos decir que un eucariota superior típico utilizará aproximadamente 3.5 ml de dioxígeno por cada kg-1 de peso corporal por minuto. Esto debe llegar a los tejidos donde se produce el metabolismo activo y mantenerse allí a una presión de estado estable de aproximadamente 2 Torr (torr se definió como equivalente a una presión de un milímetro de mercurio (mmHg). Esto asegurará una velocidad suficiente de suministro a las mitocondrias y permitirá su utilización continua en las mismas para reacciones oxidativas. El problema al que se enfrenta el organismo es cómo asegurar un suministro suficiente a todos los tejidos, incluso a los enterrados profundamente en el cuerpo, a veces mientras habita un ambiente pobre en oxígeno. Hay varias estrategias posibles para resolver este problema. Todos se han utilizado en un momento u otro en el curso de la evolución.
Difusión desde la superficie
La forma más simple (pero rara vez efectiva) de administrar dioxígeno a los tejidos que respiran es mediante una simple difusión desde la superficie del organismo. La practicidad de esta solución depende de varios factores: la concentración de dioxígeno circundante, la permeabilidad del tegumento y la distancia sobre la que debe producirse la difusión. El último factor es a menudo crítico e impide el uso de la difusión simple por animales "compactos", a menos que sean muy pequeños (unos pocos mm de diámetro). Básicamente, hay dos formas en que un organismo más grande puede disminuir la vía de difusión: primero, proporcionando invaginaciones como la tráquea de insectos y segundo, por ser muy delgado y como una hoja. Un organismo muy delgado puede, en principio, respirar eficazmente incluso si es bastante grande en otras dimensiones. ¿Qué tan delgado es esencial? Un cálculo clásico de Raff y Raff[45] (1970) ha dado respuestas aproximadas. Utilizaron una solución aproximada para las ecuaciones diferenciales para la difusión en una losa delgada que respiraba y preguntaron qué espesor permitiría mantener un nivel crítico de O2 en su centro. Si la presión ambiental fuera de 160 mm Hg (nivel de dioxígeno actual [PAL]), un grosor corporal de 1 a 4 mm podría soportar una actividad metabólica razonable. Sin embargo, si el contenido de O2fuera solo el 10% de este (un nivel precámbrico razonable, o uno que se encuentra en muchos ambientes hipóxicos en la actualidad), no se podría permitir un espesor superior a 1 mm[46].
Esto tiene implicaciones interesantes para algunos organismos precámbricos, especialmente la fauna ediacárica. Un ejemplo se puede encontrar en la criatura con forma de hoja (Dickinsonia). Aunque tenía hasta 1 m de diámetro, Dickensonia tenía solo unos pocos mm de espesor. Aún no se sabe con certeza si Dickensonia pudo haberse metabolizado sobre la base de la difusión de dioxígeno porque no conocemos la presión de dioxígeno ambiental en los últimos tiempos del Precámbrico o la actividad del organismo. Sin embargo, es intrigante que la mayoría de los organismos de Ediacara eran como hojas y ninguno mostraba evidencia de un sistema circulatorio. Es posible que pastaran o vivieran cerca de esteras bacterianas fotosintéticas que habrían proporcionado una concentración de O2 localmente más alta. Hay una serie de organismos vivos que dependen de la difusión (gusanos planos, protistas, celenterados), pero son invariablemente delgados; a menudo solo unas pocas capas de células de espesor.
Por supuesto, todos aquellos animales que portan caparazones, otras coberturas corporales impermeables o miden más de unos pocos milímetros, simplemente no pueden depender de la difusión de dioxígeno desde la superficie exterior. Deben utilizar algún tipo de sistema circulatorio para llevar dioxígeno de los pulmones o las branquias a los tejidos. Probablemente hubo una presión evolutiva en el Precámbrico tardío que exigió una solución drástica al problema del suministro de oxígeno. La delgadez puede haber sido solo un intento, y en gran medida sin éxito.
3.15 Transporte a través de la sangre como gas disuelto
La sangre (o como se la suele llamar en los invertebrados, hemolinfa) desprovista de una proteína transportadora de oxígeno (OTP) circula a través de un "intercambiador de gases" (pulmón o branquias) y luego a los tejidos, puede transportar un gas soluble. Esto puede funcionar bastante bien en el sentido inverso para la eliminación de CO2, un producto muy soluble del metabolismo aeróbico, pero es mucho menos exitoso para la liberación de O2. El dioxígeno no es muy soluble en agua. Por ejemplo, en la sangre humana, el dioxígeno disuelto representa solo alrededor del 2% de lo que puede ser transportado por la hemoglobina presente.
A pesar de la ineficacia de este método de transporte, existen organismos que lo utilizan. Muchos tienen tasas metabólicas bajas. Por otro lado, los organismos que viven en agua fría encontrarán más dioxígeno y pueden vivir solo con el dioxígeno disuelto físicamente como lo hacen algunos peces antárticos. Cabe señalar que el dioxígeno es aproximadamente un 60% más soluble en agua de mar a 0 ºC que a 20 ºC. Un ejemplo interesante se encuentra en el "pez de hielo" antártico de la familia Channichthyidae. Estos peces son únicos entre los vertebrados por no tener hemoglobina en absoluto; incluso carecen de genes de globina esenciales[47]. Tampoco utilizan ninguno de los otros dioxígeno transportistas que discutiremos más adelante. Su metabolismo no es excesivamente lento, por lo que deben existir factores compensadores. Algunos se pueden encontrar en una tasa de circulación inusualmente alta y un aumento en la vascularización del tejido, lo que aumenta el área total de contacto entre los vasos sanguíneos y los tejidos[48]. Es de suponer que existe alguna compensación para el animal al no tener que sintetizar hemoglobina. Sin embargo, esto es inusual; todos los demás vertebrados portan hemoglobina, incluso los que viven en aguas polares. Para los grandes vertebrados activos como los humanos, el dioxígeno disuelto es completamente insuficiente. El siguiente ejemplo da una idea de por qué: dada la solubilidad del dioxígeno es 0.00003 ml O2/ml sangre/Torr. En el alvéolo, la presión parcial de oxígeno es de unos 100 Torr. Por tanto, la sangre arterial contiene 0,003 ml de O2/ml de sangre. Un hombre de 75 kg necesita al menos 0,075 ml de O2/ml de sangre asumiendo un gasto cardíaco de 5l de sangre/min y un consumo de 5 ml por kg de masa corporal y por minuto. A una concentración de solo 0,003 ml de O2 disuelto/ml de sangre a 100 Torr, el hombre de 75 kg necesitaría bombear la sangre a una velocidad 25 veces mayor para proporcionar la cantidad requerida de dioxígeno. Esto correspondería a una frecuencia de bombeo de 125 l de sangre/min, lo que no es posible: para alcanzar esta frecuencia de bombeo, el corazón necesitaría latir 25 veces más alta frecuencia, lo que significa una frecuencia de 60 25 Hz ¼ 1500 Hz! Por lo tanto, las OTP son esenciales para proporcionar la cantidad necesaria de oxígeno adicional.
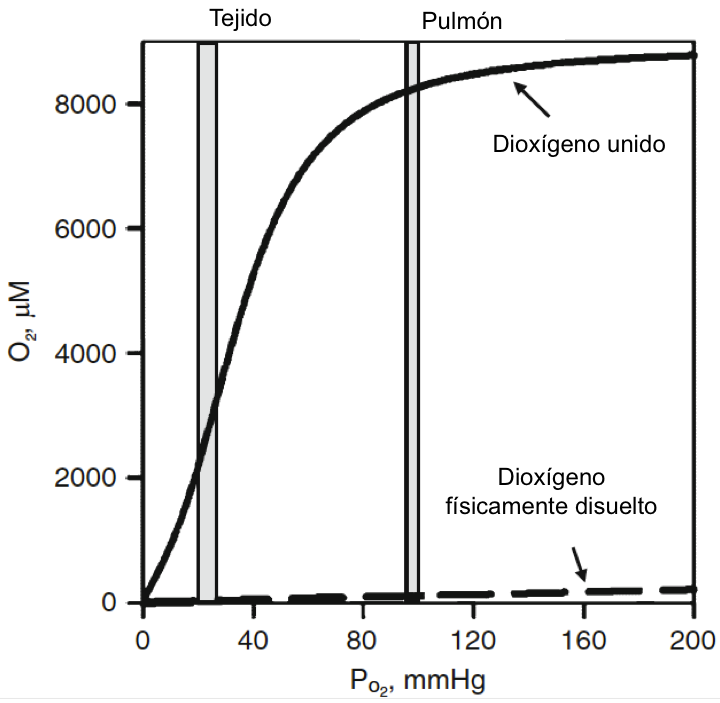
3.16 Proteínas transportadoras de oxígeno: ¿Qué deben hacer?
Dada la ineficacia de la difusión o la solubilidad del plasma en el suministro de oxígeno, no es sorprendente que casi todos los organismos superiores hayan desarrollado proteínas dedicadas al transporte de dioxígeno en la sangre. Abreviaremos estas proteínas de transporte de oxígeno como OTP. En algunos casos, estas proteínas simplemente se disuelven en el plasma; en otros, se transportan en células circulantes. En cualquier caso, la ventaja de tener una proteína de este tipo puede ser enorme.
Otra ventaja más sutil del uso de una OTP se puede ver con un examen. La solubilidad tiene una dependencia casi lineal de la pO2, mientras que la curva de la hemoglobina tiene una forma sigmoidea. Esta forma de curva es típica de la unión cooperativa, que las proteínas pueden facilitar y que pueden hacer que la carga y descarga del dioxígeno sea mucho más eficiente. Tendremos mucho más que decir sobre la vinculación cooperativa más adelante. Por ahora, también debemos tener en cuenta que el enlace cooperativo tiene una característica corolario: permite el control alostérico del enlace. Esto significa que otras sustancias involucradas en el metabolismo pueden actuar para afinar el proceso de suministro de oxígeno. Los controles cooperativos de unión a O2y alostérico son características de la mayoría de las OTP.
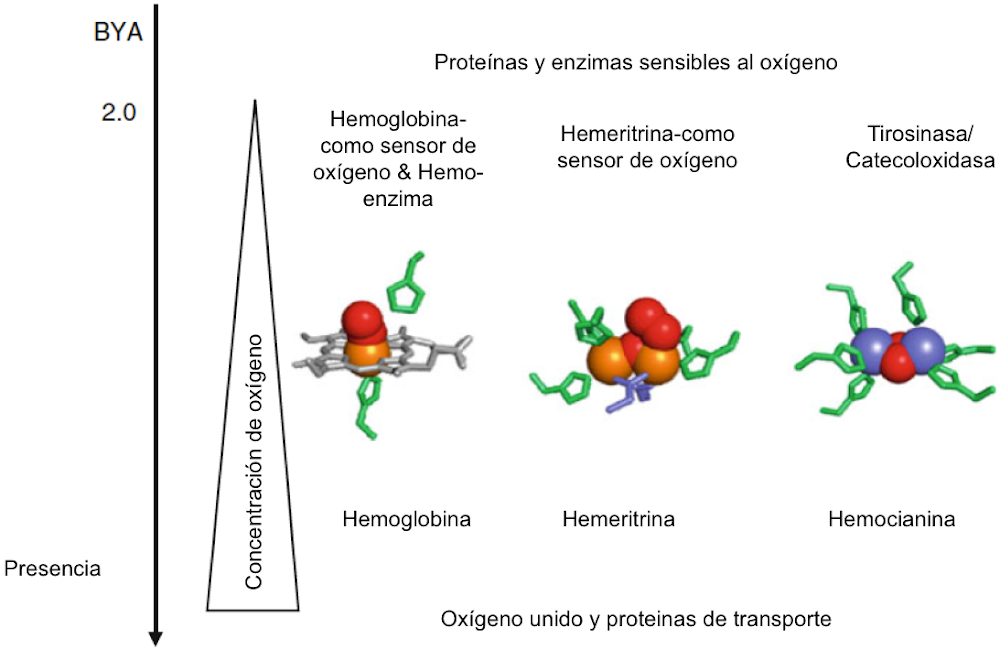
Fig. 5.2 Sitios de unión para dioxígeno en diferentes OTP. (a) Hemoglobina: el dioxígeno está unido entre el átomo de hierro en el centro del anillo de porfirina y un residuo de histidina. (b) Hemeritrina: el dioxígeno está unido de forma compleja entre dos átomos de hierro. (c) Hemocianina: el dioxígeno está unido entre dos átomos de cobre. Código de color: hierro (naranja), cobre (azul), oxígeno (rojo). Las proteínas de transporte de oxígeno actuales evolucionaron a partir de proteínas y enzimas sensores de oxígeno con una concentración creciente de oxígeno en la atmósfera.
Para que una sustancia sirva como transportador de oxígeno en la sangre, debe ser capaz de aceptar dioxígeno de una superficie en contacto con aire o agua externos (pulmón, branquias), circular a los tejidos y liberar allí el dioxígeno. El soporte no debe oxidarse irreversiblemente por el dioxígeno. Parece, a partir de la historia evolutiva, que los metales de transición en sus estados de oxidación más bajos, particularmente el hierro (2) y el cobre (1), son especialmente adecuados para esta tarea. Sin embargo, no funcionarán como iones libres, ya que estos se oxidarían rápidamente. Por lo tanto, invariablemente son transportados en proteínas, que brindan, de una manera aún no completamente comprendida, protección contra la oxidación irreversible. En la actualidad, todas las OTP conocidas contienen Fe(2) o Cu(1) en sus sitios de unión a dioxígeno, y no conocemos evidencia de ninguna otra. Los sitios que se encuentran en las cuatro clases reconocidas (hemoglobinas, hemeritrinas y dos tipos de hemocianina) y las características generales de estas clases de proteínas. En las cuatro clases, hay cambios en la distribución del espín electrónico o en la carga electrónica de los iones metálicos al unirse al oxígeno y estos acompañan a los cambios en la geometría de la proteína local. Estos cambios también se reflejan en cambios espectroscópicos, que en algunos casos (especialmente la hemocianina) producen un color visible cambios. En la hemocianina, el cobre se oxida en realidad por el dioxígeno unido, lo que da como resultado un color azul, pero esto se revierte con la liberación de oxígeno. Las geometrías de sitios activos para cada clase ahora se han determinado mediante estudios de difracción de rayos X de alta resolución[49].
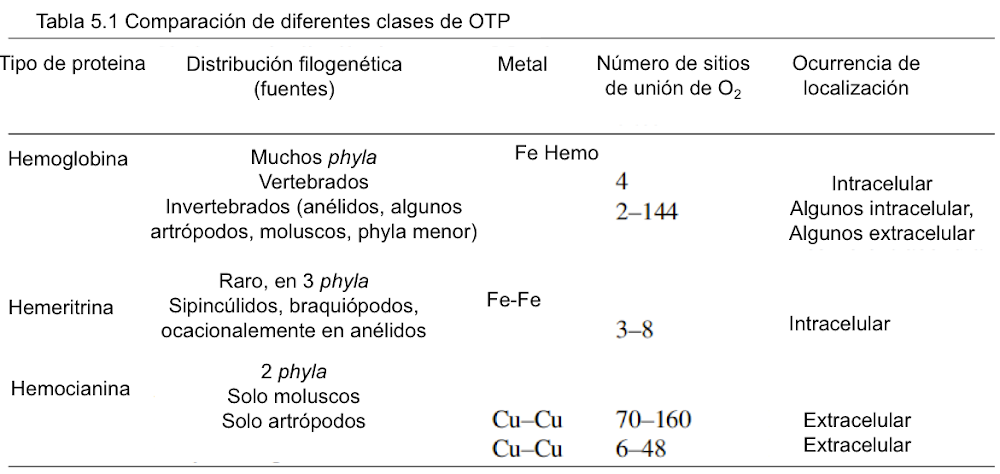
3.17 Modos de unión del dioxígeno a las proteínas transportadoras de oxígeno
3.17.1 Vinculación cooperativa y no cooperativa
Existen dos formas distintas en las que una proteína puede unirse a un dioxígeno similar a una molécula pequeña (a menudo llamado ligando): la unión puede ser cooperativa o no cooperativa. El requisito molecular para los dos es diferente y su funcionalidad es muy diferente. En la unión cooperativa, la ocupación de algunos sitios de unión modifica la afinidad de otros sitios por el ligando. Esto requiere algún tipo de comunicación, directa o indirecta, entre sitios vinculantes. En la vinculación no cooperativa, los sitios son completamente independientes entre sí: un sitio determinado no tiene "conocimiento" del estado de ningún otro sitio. Como veremos, la unión cooperativa es más útil en el transporte de oxígeno, la unión no cooperativa se encuentra generalmente en proteínas utilizadas para almacenamiento de dioxígeno, como mioglobina.
Un simple análisis del comportamiento vinculante puede distinguir fácilmente entre vinculación cooperativa y no cooperativa. Esto se expresa como una curva de unión. En tales curvas, graficamos la fracción de sitios llenos en la muestra frente a la actividad del ligando, que se puede expresar en el caso de los gases como concentración de gas disuelto o presión parcial del gas. Para el dioxígeno, lo designamos como pO2. Un resultado típico de la unión no cooperativa es una curva hiperbólica, que solo se acerca lentamente a un límite a medida que la pO2 aumenta (curva A). Por el contrario, un aglutinante cooperativo muestra la curva sigmoidea B muy diferente. Discutiremos los posibles mecanismos de unión cooperativa a continuación. Pero por ahora, bastará con una imagen cualitativa. La curva cooperativa actúa como si comenzara con una pO2 baja con una unión débil, que se vuelve más fuerte a medida que se agregan más y más dioxígenos. Esto le da la forma sigmoidea. Su ventaja en el transporte de dioxígeno es la siguiente: un aglutinante cooperativo puede cargar casi completamente a una pO2moderada y, sin embargo, descargar casi por completo a la menor concentración de oxígeno en los tejidos.
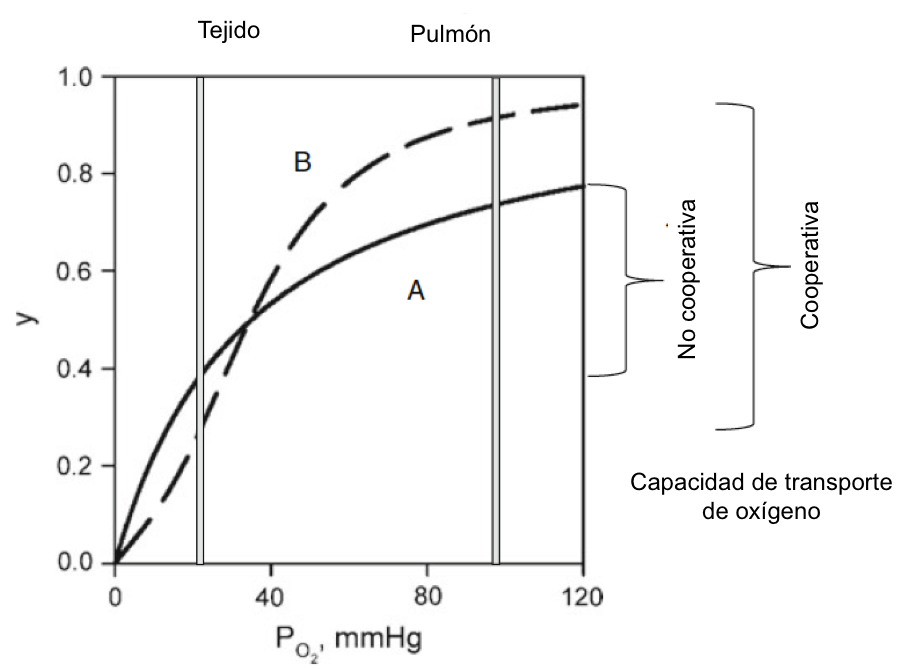
Fig. 5.3 Comparación de la unión no cooperativa (A) y cooperativa (B) de oxígeno a una OTP. Las dos bandas representan aproximadamente las presiones de oxígeno en los pulmones y los tejidos, respectivamente. Tenga en cuenta cuánto más eficaz será B en la administración de oxígeno. La abscisa (Y) representa la fracción de saturación.
A medida que la cooperatividad se vuelve cada vez más fuerte, el sistema comienza a actuar como un "interruptor molecular" que casi no produce unión por debajo de un valor crítico y una saturación casi completa por encima. La unión cooperativa es una forma de alosterio, el fenómeno en el que la unión de un ligando puede influir en la unión de otros. Dado que en este caso la unión de dioxígeno influye en la unión de dioxígeno adicional, lo llamamos alosterio homotrópico. ¿Qué se requiere para la vinculación cooperativa? La esencia de la cooperatividad es que un sitio de unión está informado de alguna manera del estado de otros sitios de unión: ¿están ocupados o vacíos? Solo de esta manera pueden las moléculas responder cambiando la afinidad del sitio X en respuesta a la ocupación del sitio Y. Esto requiere que haya algunas conexiones, covalentes o no covalentes, entre los sitios de unión. En la naturaleza, esto se ha logrado de dos maneras: (a) La unidad molecular que contiene los sitios que se duplican en una estructura de proteína multidominio en tándem, como consecuencia de la duplicación de genes en tándem. (b) Con mayor frecuencia, las unidades de unión de oxígeno de las proteínas individuales pueden asociarse para formar oligómeros no covalentes. En cualquier caso, las unidades funcionales individuales, cada una con un sitio de unión, deben comunicarse. Veremos que estos métodos de generar estructuras potencialmente cooperativas vinculantes se han utilizado una y otra vez en la evolución. Diversos tipos de organismos han buscado satisfacer la necesidad de unión cooperativa de diversas formas, pero invariablemente se combinan múltiples unidades de unión, covalente o no covalentemente, para formar la molécula funcional.
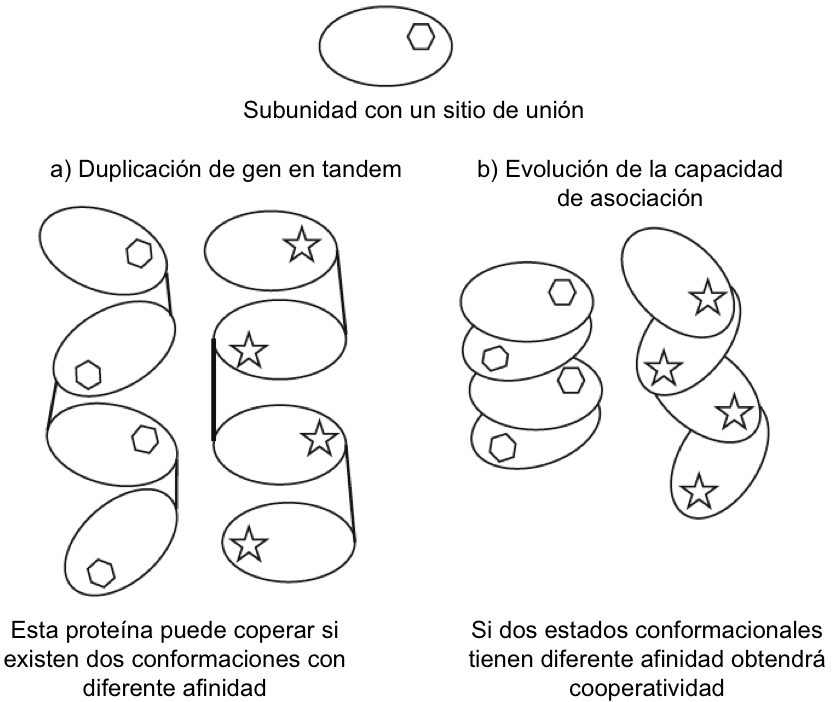
Fig. 5.4 Dos formas en las que la vinculación cooperativa podría evolucionar. (a) Por duplicación de genes en tándem, una proteína lleva varios sitios de unión al oxígeno en diferentes dominios y unidades funcionales. (b) Más a menudo, proteínas individuales que llevan un sitio de unión al oxígeno asociado a oligómeros no covalentes. Pueden adoptar dos conformaciones diferentes caracterizadas por diferentes afinidades, indicado por los diferentes símbolos.
¿Cómo funciona la cooperatividad?: Modelos para Allostery
La cooperatividad solo puede garantizarse cuando los sitios de unión al oxígeno están en comunicación entre sí. Todavía hay una discusión sobre si la cooperatividad puede establecerse por unidades funcionales individuales que experimentan la transición de un estado de unión débil a fuerte una a la vez o si la cooperatividad observada es el resultado de la posibilidad de que todas las moléculas OTP multisitio tengan dos conformaciones generales, que difieren en la afinidad por el oxígeno. La primera posibilidad requiere que se propague algún tipo de cambio conformacional de cada unidad funcional a otra a medida que se une el dioxígeno. Este tipo de modelo fue propuesto por primera vez por Koshland, el segundo tipo de modelo requiere cambios concertados en una estructura de múltiples subunidades[50]. Aquí, las moléculas de OTP de múltiples subunidades completas pueden presentarse en un estado de alta (R) o baja afinidad (T) caracterizado por diferentes afinidades de las subunidades al oxígeno. El modelo requiere que todas las subunidades tengan el la misma afinidad del mismo oxígeno y cambiar sincrónicamente de una conformación a la otra.
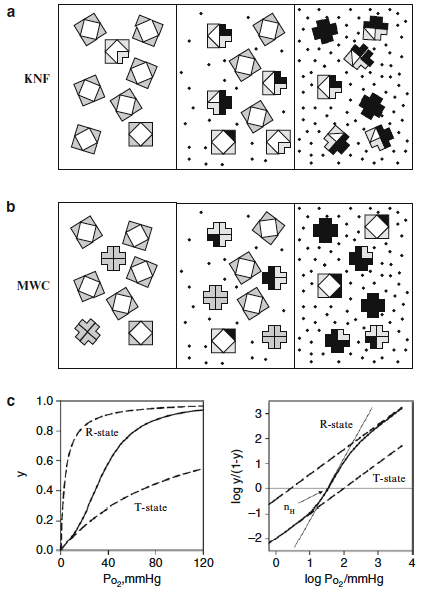
Fig. 5.5 Dos modelos principales de enlace cooperativo. (a) La unión de dioxígeno a una subunidad modifica la afinidad de las subunidades vecinas (modelo KNF secuencial). (b) Un conjunto (la unidad alostérica) puede adoptar dos conformaciones diferentes caracterizadas por diferentes afinidades por el oxígeno. Dentro de cada conformación, después de la unión de dioxígeno, no influye en los otros sitios de unión (modelo MWC concertado). Los puntos oscuros representan moléculas de oxígeno, cuya concentración aumenta de izquierda a derecha. (c) Aquí se muestra una curva de unión cooperativa para una mezcla de unidades alostéricas dentro de los dos estados (estados R y T). Las subunidades se unen al dioxígeno de manera no cooperativa en el estado R o T con diferentes afinidades. Pero la población del estado R aumentará a medida que avance la unión. Los datos se pueden representar como un diagrama de Hill (derecha). La pendiente de la curva de unión cooperativa a la mitad de la saturación (Y ¼ 0,5) da el coeficiente de Hill nH, una medida del grado de cooperatividad. El comportamiento de las moléculas que estaban obligadas a permanecer en los estados R o T se muestra mediante líneas discontinuas con pendiente unitaria.
Autoensamblaje y anidamiento
Como veremos, la mayoría de las OTP son proteínas de múltiples subunidades, formadas por subunidades, cada una de las cuales tiene un sitio de unión. Esta parece ser la forma más sencilla de realizar la función necesaria. Estas proteínas de múltiples subunidades se forman a través de un proceso de autoensamblaje que establece varios ejes de simetría. El autoensamblaje tiene muchas ventajas. A la concentración in vivo, todas las proteínas se asociarán como oligómeros. El mismo principio se puede utilizar para construir complejos más grandes. Los bloques oligoméricos como las hemocianinas hexaméricas han establecido todas las propiedades funcionales para comportarse como una OTP. Sin embargo, en la hemolinfa de muchos artrópodos encontramos estructuras moleculares que son múltiplos enteros (2, 4, 6 u 8) de hexámeros dependiendo de la especie[51]. Este nivel superior de organización también está formado por el autoensamblaje. Esta disposición permite a diferentes efectores modular la función en diferentes niveles estructurales a lo largo de los diversos ejes de simetría. Llamamos modelo anidado a un modelo que posee estas características[52]. Aquí, las jerarquías de los mecanismos de regulación se asignan a las jerarquías correspondientes en la estructura y función[53]. El autoensamblaje tiene una serie de ventajas. Permite que se desarrollen estructuras complejas sin ninguna proteína de andamio adicional y también da como resultado un uso más eficiente de la expresión génica; porque las subunidades mal plegadas simplemente no participarán en el proceso de ensamblaje. Esto es importante, porque los oligómeros que contienen unidades mal plegadas pueden no funcionar de manera cooperativa. En cambio, las proteínas mal plegadas serán rechazadas en el ensamblaje y degradadas. Por lo tanto, parece que construir estructuras cooperativas mediante un autoensamblaje de monómeros es más económico que construir un dispositivo cooperativo en una sola pieza a partir de un gen reiterado en tándem. Además, el material genético se utiliza de forma más económica, en el autoensamblaje.
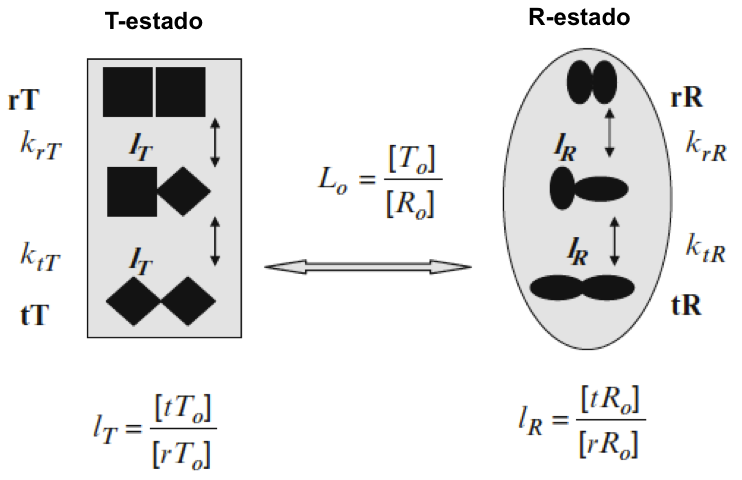
Fig. 5.6 Modelo de anidamiento. Estado T Estado R. Los complejos de proteínas grandes a menudo consisten en ensamblados de unidades alostéricas. Esto ofrece muchas posibilidades/propiedades funcionales. Las unidades alostéricas incrustadas/anidadas se pueden modular mediante interacciones entre ellos. Por lo tanto, este modelo de anidamiento respeta las jerarquías obvias en la estructura compleja de la proteína.
¿Por qué son tan complejas las proteínas con multisubunidades de transporte oxígeno?
Las moléculas que funcionan como OTP, especialmente las que se encuentran libres en la sangre de los invertebrados, son a menudo moléculas enormes y notables. ¿Por qué son tan grandes? Una razón obvia es producir una alta cooperatividad; cuantos más sitios haya en un conjunto conectado, mayor puede ser la cooperatividad. Sin embargo, esta no puede ser la respuesta completa, ya que a menudo la cooperatividad observada es mucho menor que la posible. Hay grandes OTP con muy baja cooperatividad. Por tanto, deben buscarse otras razones. Una podría ser que la oligomerización estabiliza el complejo. Cuando las OTP se exponen libremente en la hemolinfa, están rodeadas de un entorno que contiene enzimas, bacterias, etc., que pueden provocar daños moleculares. La oligomerización también protege contra la degradación natural. A menudo, los oligómeros ensamblados a partir de subunidades pueden ocultar una posible posición de escisión en sus superficies y las partes terminales C y N, a menudo flexibles, en el interior del ensamblaje. Pero este solo será el caso cuando el montaje sea perfecto.
También existen razones físicas simples para favorecer el gran tamaño en las moléculas de OTP disueltas. Para obtener una alta capacidad de transporte de oxígeno, la concentración de la proteína debe ser grande (a veces tan alta como 100 mg/ml). Esto crearía una presión osmótica coloidal muy alta si la proteína estuviera presente como subunidades libres, ya que la presión osmótica depende solo del número de partículas por unidad de volumen. Además, la viscosidad de una hemolinfa que contenga una concentración tal como unidades disociadas sería alta. La evolución ha resuelto estos problemas de dos formas. Ya sea:
(a) Haga que los agregados de múltiples subunidades sean muy grandes, si deben circular libremente en la sangre. Este es el camino que siguen muchos invertebrados.
(b) Alternativamente, empaque las moléculas de OTP en células circulatorias, como los eritrocitos en mamíferos y otros vertebrados.
Cualquiera de los modos evita la pérdida de la proteína debido a la ultrafiltración en el riñón. Por lo tanto, se logran los mismos efectos de cualquier manera. Por qué uno u otro evolucionó en diferentes filos es un misterio. Como el hecho de que diferentes filos han desarrollado diferentes OTP, esto puede ser simplemente otro ejemplo de aleatoriedad de caminos evolutivos.
Modulación del suministro de dioxígeno por las proteínas transportadoras de oxígeno: heteroalosterio
El funcionamiento óptimo de las OTP en los cuerpos de los animales requiere que entreguen el nivel adecuado de dioxígeno a los tejidos. Este requisito se vuelve particularmente agudo en circunstancias especiales, como cuando, bajo un ejercicio intenso, el metabolismo aeróbico se fuerza al límite y las vías anaeróbicas se utilizan. Para responder a tales situaciones, las moléculas efectoras que se unen a otros lugares excepto en el sitio activo ayudarían. Ya hemos señalado que la unión cooperativa (alosterio homeotrópico) aumenta la eficiencia de la descarga de dioxígeno. Pero el alosterio heterotrófico, en el que otras moléculas (efectores alostéricos) o iones pueden modificar la eficiencia del transporte, es de igual importancia. Damos algunos ejemplos que son bastante generales sobre todo el reino animal.
Modulación por los productos del metabolismo anaeróbico: el efecto Bohr
En muchos animales, el metabolismo aeróbico se reemplaza parcialmente por el metabolismo anaeróbico bajo estrés por ejercicio. Un producto común de este último es el ácido láctico, que se secreta a la sangre. Aunque el lactato en sí da como resultado una mayor afinidad de la OTP por el dioxígeno, los protones liberados compensan este efecto para hacer que la descarga de dioxígeno por la OTP sea más eficiente al estabilizar el estado de baja afinidad, contrarrestando así la deficiencia de O2. Esta dependencia de la afinidad por el oxígeno de la concentración de proteína (logp50 / log [H+]) se conoce como efecto Bohr[54]. Otra contribución al efecto Bohr proviene del alto nivel de CO2 transportado desde los tejidos a la sangre cuando el ejercicio es pronunciado. La concentración de protones aumenta debido al aumento de dióxido de carbono liberado en la hemolinfa para formar H2CO3 de acuerdo con:
 13.49.06.png)
donde el H2CO3 se disocia rápidamente por una enzima, la anhidrasa carbónica presente en los eritrocitos, para producir
 13.49.11.png)
Por tanto, el CO2 forma iones y protones de HCO3. Estos protones disminuyen el pH de la sangre o la hemolinfa, desplazando una curva de unión al oxígeno hacia la derecha, lo que da como resultado una liberación de dioxígeno unido a la OTP. Este efecto ocurre alrededor del rango de pH fisiológico entre 7 y 7.5. El mecanismo molecular de la hemoglobina se conoce desde hace décadas[55]. Por supuesto, si la demanda de oxígeno sigue superando el suministro, el tejido se vuelve cada vez más ácido hasta que finalmente no puede funcionar.
El efecto Haldane
Hemos visto que la unión de protones facilita la liberación de dioxígeno de muchas OTP (el efecto Bohr). A la inversa, la unión de dioxígeno (como en los pulmones) libera protones de las moléculas de OTP y hace que la sangre sea más ácida. Esto favorece la liberación de CO2 del bicarbonato, seguida de la difusión a través de la membrana de los eritrocitos y permite su exhalación de los pulmones.
 13.52.26.png)
Este efecto Haldane explica cómo se transfiere el CO2 de los eritrocitos. Puede considerarse como la función inversa del efecto Bohr. Por tanto, la desoxigenación de la sangre provoca un aumento del dióxido de carbono disuelto. Viceversa, la sangre oxigenada tiene una capacidad reducida de dióxido de carbono. Esto es una consecuencia del hecho de que la OTP reducida (desoxigenada) es un aceptor de protones pero no la forma oxigenada. Esta simple acomodación molecular facilita tanto la liberación de O2 a los tejidos como la liberación de CO2 en los pulmones, un caso notable de eficiencia bioquímica.
El efecto raíz
Las OTP no solo se utilizan para el suministro de oxígeno, sino también para satisfacer otras necesidades fisiológicas. Uno que podría no esperarse es la flotación de peces. El agua es un entorno excelente para la vida, pero la natación consume energía. Es más relajante para un organismo mantener su flotabilidad corporal neutra (es decir, tener la misma densidad general que el agua circundante). Entonces, el organismo no tiene que trabajar para evitar que su cuerpo flote hacia arriba o se hunda hacia abajo. Una solución para mantener la flotabilidad neutra se logró en un gran número de peces óseos al desarrollar una vejiga que contiene gas como un órgano hidrostático, que se puede llenar o vaciar para lograr la densidad deseada para el pez entero. Este efecto se puede lograr mediante isoformas de hemoglobina. Aquí, la regulación de la liberación de dioxígeno de la sangre a la vejiga también se controla aumentando la concentración de protones a valores de pH muy bajos, es decir, 6,5. Esta función se limita localmente a una pequeña región denominada rete mirabile (en latín, red maravillosa) con células epiteliales especializadas (las células gigantes gaseosas) asentadas en la superficie de la vejiga gaseosa[56]. Están involucradas vías metabólicas específicas, que producen ácido láctico a través de la vía glucolítica y CO2 a través del ciclo de las pentosas fosfato. La caída del pH en la rete mirabilis libera una gran fracción del dioxígeno transportado por las isoformas de hemoglobina especializadas hacia la vejiga.
Esta notable capacidad, llamada efecto raíz, permite a las hemoglobinas bombear dioxígeno desde el vaso sanguíneo contra un gradiente alto de O2 hacia la vejiga de gas. Para ello, los peces han desarrollado isoformas de hemoglobina con propiedades especiales. A un pH bajo, como <6,5, estas isoformas de hemoglobinas pierden la capacidad de unirse al dioxígeno de manera cooperativa, en lugar de unirse al dioxígeno de manera no cooperativa con una afinidad muy baja. Así, el dioxígeno se libera en la sangre como dioxígeno físicamente disuelto, lo que resulta en un tremendo aumento de la pO2, alcanzando valores de más de 700 Torr en la rete mirabilis que son mucho más altos que los de la vejiga gaseosa.
Por tanto, se crea un gradiente de dioxígeno pronunciado entre la sangre y la vejiga de gas, lo que obliga al dioxígeno a difundirse en la vejiga de gas. Sin embargo, la capacidad total de unión al oxígeno de la sangre se reduce solo ligeramente. Para no perder funcional el transporte de dioxígeno completamente en estas condiciones, la sangre debe contener al menos dos isoformas diferentes[57]. Un tipo proporciona el efecto raíz, pero los otros tipos poseen el efecto Bohr normal, que es responsable del suministro de oxígeno a los tejidos. Así, el efecto Raíz abre una nueva vía evolutiva utilizando la física adecuada para superar las condiciones ambientales: flotar dentro de un líquido.
El efecto raíz también se encuentra en órganos distintos de la vejiga gaseosa, como los ojos de algunos peces. Tienen una red coroidea (la coroides es el espacio vascular entre la retina y la esclerótica[58]). Al igual que en la vejiga natatoria, la sangre que fluye hacia la coroides se vuelve más ácida, por lo que se libera el dioxígeno unido. El dioxígeno se difunde en el ojo para satisfacer las necesidades metabólicas más elevadas de las células retinianas y las neuronas asociadas. La ventaja fisiológica puede ser que los peces de aguas profundas mantengan altos niveles de oxigenación en los tejidos de la retina. La rete aísla tanto la acidez como la alta concentración de dioxígeno a la circulación alrededor del ojo.
Dependencia de la temperatura
Muchos organismos, especialmente los invertebrados, adaptan su temperatura corporal a la temperatura ambiental. Los cambios de temperatura también cambiarán el pH de la sangre y, por lo tanto, pueden influir en el transporte de oxígeno. Este, sin embargo, es un tema que a menudo se pasa por alto. El aumento de temperatura da como resultado una disminución del pH de una solución acuosa. El resultado es desplazar la curva de enlace de oxígeno hacia la derecha, lo que resulta en una afinidad más baja. Por lo tanto, la OTP liberará más dioxígeno que se necesita debido a una mayor actividad a temperaturas más altas. Pero dependiendo de las condiciones ambientales, la función óptima de unión de dioxígeno también puede cambiar. Por lo tanto, para cada organismo, debe haber una dependencia particular del pH-T con respecto a la cooperatividad y la afinidad. Cuanto mayor sea la cooperatividad, más dioxígeno se liberará de las OTP con un pequeño cambio en la pO2. Por otro lado, un panorama amplio de pH-T garantiza que las OTP seguirán proporcionando suficiente dioxígeno en condiciones no ideales. En los extremos, sin embargo, no se liberará suficiente O2 a los tejidos, aunque las OTP pueden incluso estar completamente cargadas con dioxígeno. Un ejemplo es el pulpo, que se asfixiará en los mares polares fríos, cuando las bajas temperaturas dan como resultado una alta afinidad, la hemocianina no liberará suficiente dioxígeno a los tejidos aunque haya mucho dioxígeno disponible dentro de esos organismos.
Las altas temperaturas también causan otro problema para los organismos terrestres, si van acompañadas de una disminución de la humedad. El vapor de agua es importante para la respiración, ya que cubre las áreas respiratorias como la capa de células epiteliales que forman los alvéolos en la profundidad de los pulmones. Esto evita que se peguen entre sí, por lo que el dioxígeno no puede pasar. Algunas arañas viven en tubos largos y estrechos al final de los cuales la temperatura puede estar por debajo de los 30º C, en condiciones muy húmedas, mientras que en la entrada el sol calienta la atmósfera a más de 70º C con una humedad muy baja. El tubo proporciona un refugio contra la deshidratación.
Aspectos evolutivos de la regulación
El efecto Bohr en los peces parece haber evolucionado al menos 500 MYA cuando los peces aparecieron por primera vez en los océanos, mientras que el Efecto Raíz evolucionó junto con la vejiga gaseosa alrededor de 350 MYA seguido de la coroides a unos 250 MYA. Sin embargo, como se reveló en un estudio reciente[59], la evolución de una vejiga natatoria ocurrió de forma independiente al menos cuatro veces entre los peces. Durante los últimos 100 millones de años, el rete de la vejiga natatoria, el rete de la coroides y, sorprendentemente, incluso el efecto Bohr se han perdido varias veces en varios grupos de peces y, en ocasiones, se han recuperado nuevamente. Sin embargo, parece que el Efecto Raíz siempre está presente cuando el animal posee una rete mirabile. Parece que cuando no se ha desarrollado rete mirabile, las hemoglobinas carecen del efecto raíz. Esto se observa para las hemoglobinas de los peces no teleósteos y de los tetrápodos y vertebrados terrestres más complejos donde no se esperaría una rete mirabilis. Si bien la base estructural del efecto Bohr es clara, la base del efecto raíz sigue siendo controvertida, ya que aún no se ha encontrado una estructura molecular única que lo explique[60].
Diversidad de proteínas transportadoras de oxígeno
Como indica la Tabla 5.1, existen cuatro clases de OTP. Las cuatro clases se distribuyen de una manera muy peculiar entre los filos de los animales. Las hemoglobinas son casi ubicuas, con ejemplos en algunas especies en casi todos losphylum[61]. Por otro lado, las hemeritrinas son las OTP principales en solo dos filos menores, y también ocurren, pero rara vez, en los anélidos. Las hemocianinas de artrópodos y moluscos se encuentran solo en sus respectivos phyla, pero algunos artrópodos y moluscos tienen hemoglobina en lugar de hemocianina o ambos. A pesar de sus nombres comunes y algunas características comunes en el sitio de unión con sus átomos de cobre, las hemocianinas de artrópodos y moluscos son proteínas bastante distintas[62] sin evidencia clara de ascendencia común. Su distribución ubicua indica que la familia de genes de la hemoglobina es muy antigua, anterior a la divergencia de la mayoría de los filos animales. Los moluscos y la hemocianina de artrópodos, por otro lado, deben haber surgido solo después de que sus filos específicos divergieran, ya que no hay ejemplos de "cruzamiento". Ahora examinamos algunas de esas proteínas con más profundidad.
Fig. 5.7 Distribución filogenética de las proteínas transportadoras de oxígeno. Se muestra la distribución esquemática de las tres principales OTP diferentes (globinas, hemocianinas y hemeritrinas) entre los filos.
Hemoglobinas
La palabra hemoglobina connota una enorme clase de proteínas, de estructuras tremendamente variadas, pero casi con seguridad una ascendencia evolutiva común. El nombre incluso se ha aplicado a una serie de proteínas hemo intracelulares monoméricas que, como la mioglobina, parecen almacenar o transmitir dioxígeno dentro de las células o funcionar como sensores de oxígeno. Sin embargo, estas no son OTP en el sentido que usamos aquí. Todas las hemoglobinas de transporte se forman a partir de subunidades similares a la mioglobina o copias en tándem del gen de la globina. El número de subunidades varía de 2 (la más pequeña para permitir la unión cooperativa) a 144. Aunque las hemoglobinas de la mayoría de los organismos se transportan en las células circulatorias, algunas de las muy grandes están libres en la sangre. Se han determinado muchas estructuras moleculares. Todos los animales vertebrados (incluidos nosotros mismos) tienen el tipo de hemoglobina tetramérica[63]. Sin embargo, algunos invertebrados tienen transportadores de oxígeno mucho más elaborados. La hemoglobina de la lombriz de tierra común Lumbricus terrestris tiene la enorme y elegante estructura. Contiene 144 cadenas de globina, cada una con un sitio de oxígeno hemo. Además, hay 36 cadenas "enlazadoras", que forman una estructura en forma de collar que mantiene unido todo el conjunto[64].
Un ejemplo bastante diferente de complejidad de la hemoglobina es el que se encuentra en el camarón de salmuera, Artemia[65]. Aquí, la estructura de múltiples subunidades no está formada por la autoasociación de unidades de globina, sino por una duplicación genética repetida que ha llevado a la formación de matrices en tándem de nueve unidades de genes de globina, que se traducen en dominios de proteínas monoméricas. En realidad, hay dos variedades de matrices, que se combinan para formar una estructura de "collar" de 18 unidades. Recientemente, también se encontró hemoglobina en los insectos donde se pensó durante mucho tiempo que no era necesaria ya que el sistema de tráquea es muy eficaz[66].
Hemos enfatizado estos ejemplos de una enorme diversidad para resaltar el siguiente punto: la función de la hemoglobina, como transportador de oxígeno, parece haber sido inventada una y otra vez en diferentes filos. Sin embargo, esto de ninguna manera describe los límites de la invención evolutiva para la función OTP. Considere las otras clases de OTP completamente diferentes.
Hemeritrinas
Las hemeritrinas, que se encuentran solo en unos pocos filos de invertebrados, representan una clase de OTP que contienen hierro completamente distinta de las hemoglobinas[67]. El sitio de unión al oxígeno no contiene un hemo, sino un par de átomos de Fe (2[68]). La estructura molecular de la subunidad básica de hemeritrinas es completamente diferente a la de las globinas. La proteína se pliega en tres dimensiones en un motivo común, un paquete de cuatro hélices, que contiene los residuos que coordinan el hierro. Las hemeritrinas existen en estructuras triméricas u octoméricas y hay una miohemeritrina monomérica análoga a la mioglobina. La evidencia reciente indica que las hemeritrinas actuales han evolucionado a partir de tales precursores monoméricos[69]. La hemeritrina puede ser evolutivamente antigua (considerando los filos en los que se encuentra), pero parece haber representado un experimento evolutivo bastante infructuoso.
Hemocianinas
No solo el hierro se usa para unir oxígeno por OTP, dos tipos de proteínas usan cobre. El modo de unión es sorprendente, ya que los dos átomos de cobre en el sitio activo se presentan como Cu (I) con una capa d10 completamente saturada. Normalmente, tal átomo sería inerte; sin embargo, el dioxígeno se une reversiblemente como peróxido, mediante transferencia de electrones, formando un centro Cu(II)-O2 2-Cu (II). Existen dos OTP a base de cobre, las hemocianinas de artrópodos y moluscos. Cada uno une el dioxígeno en coordinación "lateral". El cambio en los estados electrónicos de los iones de cobre en la hemocianina oxigenada determina otra característica: se vuelven de un azul profundo con la oxigenación. Sin embargo, las hemocianinas de moluscos y artrópodos tienen poco más en común. Son completamente diferentes en sus estructuras moleculares. Aunque la similitud en el sitio de unión del dioxígeno sugiere alguna relación distante entre las proteínas, algunas autoridades consideran que no están relacionadas[70]. Sin embargo, recientemente, una comparación de los motivos de plegamiento reveló que las hemocianinas de artrópodos y moluscos poseen un dominio similar a la cupredoxina que probablemente sirvió para la carga de cobre en el sitio activo en los primeros tiempos. Durante la evolución, la adaptación de este dominio da como resultado diferentes funciones como elementos de conexión o transferencia de fuerza alostérica[71].
Fig. 5.8 Estudio esquemático de las enormes moléculas extracelulares de hemoglobina y hemocianina. Se dan los números de las subunidades y los sitios de unión al oxígeno. Las barras azules representan las masas moleculares aproximadas en cada clase. La hemoglobina humana tetramérica se encuentra dentro de los eritrocitos.
 14.31.33.png)
Fig. 5.9 Estructura de la hemoglobina humana. La hemoglobina humana tetramérica se compone de dos tipos de subunidades diferentes: dos a (azul) y dos b (rojo). Cada uno une un dioxígeno mediante un átomo de hierro (bola verde) en el centro de un anillo de porfirina (verde) que se fija en un bolsillo de la globina.
Hemocianina de moluscos
Una clase única de hemocianinas se encuentra solo en los moluscos. Sin embargo, estas no son las únicas OTP en el filo. En cambio, algunos moluscos tienen hemoglobinas. Algunos caracoles tienen ambos, con hemocianina en la hemolinfa y mioglobina como proteína de almacenamiento de oxígeno en la rádula. Las hemocianinas de los moluscos muestran un patrón estructural común. Cada uno está formado por 10 subunidades que pueden dimerizarse a una hemocianina de 20 subunidades. Cada subunidad, a su vez, representa matrices en tándem de siete a ocho "unidades funcionales" (UF) en una enorme cadena polipeptídica. Cada FU contiene un sitio de unión de oxígeno: un par de cobre. Por tanto, una hemocianina de molusco intacta puede contener hasta 160 UF.
Esto significa que se trata de moléculas muy grandes ya que cada FU tiene una masa molecular de aproximadamente 50.000 Da[72]. Los 10 o 20 meros, que son las moléculas funcionales con masas moleculares de hasta 8 millones de Dalton, son estructuras cilíndricas con simetría quíntuple. En la figura siguiente se muestra una estructura representativa, junto con la estructura de mayor resolución de una FU que se ha determinado[73] . Las hemocianinas de moluscos siempre se encuentran disueltas en la sangre, a menudo en concentraciones muy altas.
 15.29.50.png)
Fig. 5.10 Molécula de hemocianina de moluscos. La hemocianina más grande con 160 sitios de unión al oxígeno (de la hemocianina KLH1 de lapa californiana) está compuesta de subunidades (mostradas en diferentes colores) cada una con ocho unidades funcionales (UF). Cada FU se pliega en dos dominios diferentes, el azul lleva el sitio activo con un par de cobre que se muestra como bolas naranjas (imagen de la derecha). El dominio de cupredoxina C-terminal se muestra como un bucle naranja.
Hemocianinas de artrópodos
Entre los artrópodos, las hemocianinas se encuentran principalmente en crustáceos como langostas y cangrejos y quelicerados (como arañas, escorpiones y cangrejos herradura), pero también en algunos insectos e isópodos[74]. Mientras que en los dos últimos la función es aún incierta; todas las demás hemocianinas de artrópodos sirven como OTP. Representan la mayor fracción de proteínas disueltas en la hemolinfa de crustáceos y quelicerados. Las hemocianinas más pequeñas que se producen de forma nativa constan de seis subunidades[75]. Cada subunidad se pliega en tres dominios caracterizados por diferentes motivos de pliegue. El primero consta de cinco a seis hélices a, el segundo es un "paquete de cuatro hélices a" que lleva el sitio activo y el tercer pliegue en otro motivo, un barril b. El dominio del sitio activo tiene una similitud leve, pero intrigante, con las hemeritrinas. Tres de estas subunidades en forma de riñón se asocian espalda con espalda como un trímero, estableciendo un eje de rotación triple. Dos de estos trímeros se dimerizan en sándwich a lo largo de los tres ejes, girando 60º sobre estos ejes entre sí. Dependiendo de la especie, se encuentran estos hexámeros o múltiplos enteros de ellos (1 6, 2 6, 4 6, 6 6 y 8 6). Estas estructuras proporcionan la base para la unión cooperativa de oxígeno, incluidos ejemplos de la cooperatividad más fuerte observada en la naturaleza. Además, solo las hemocianinas ensambladas poseen amplias propiedades funcionales. Curiosamente, solo se han encontrado in vivo incluso múltiplos de hexámeros de hemocianinas, pero nunca intermedios como dímeros o trímeros. Esto requiere mecanismos de control sofisticados. El control opera a través del proceso de autoensamblaje; no se incorporarán subunidades mal dobladas. Una nueva técnica, la microscopía crioelectrónica, permitió resolver la estructura de estas estructuras muy grande.
Fig. 5.11 Estructuras de hemocianina de artrópodos. La estructura básica es un hexámero que tiene una simetría triple. Múltiplos de hexámeros (1X6, 2X6, 4X6, 6X6, 8X6) se encuentran dependiendo de la especie. Cada subunidad consta de tres dominios con diferentes motivos de plegado representado por diferentes colores (verde, rojo, azul). Los dominio medio (el rojo contiene el sitio activo). En el ampliación del segundo dominio (a la derecha), los cobres están representados por bolas naranjas, dioxígeno en azul.
Evolución de las proteínas transportadoras de oxígeno
Como hemos argumentado, las OTP se vuelven esenciales solo para animales macroscópicos que utilizan metabolismo aeróbico. Los animales muy pequeños o muy delgados no los necesitan, y no podría haber sido ventajoso hasta que los niveles de dioxígeno en el mar se hubieran elevado por encima del punto Pasteur, una concentración de dioxígeno a la que los microorganismos (aeróbicos o anaerobios facultativos) se adaptaron a la respiración aeróbica. En este punto, se desarrollaron mecanismos para integrar el dioxígeno en el metabolismo a fin de obtener mucha más energía. El punto Pasteur a una concentración de aproximadamente el 1% de la concentración atmosférica actual corresponde a una presión parcial de oxígeno de aproximadamente 1.5-2 Torr que es al menos necesaria para permitir cualquier difusión de dioxígeno en las mitocondrias para generar moléculas de ATP.
Las OTP se volvieron especialmente importantes cuando comenzó la depredación, ya que permitieron el desarrollo de conchas y caparazones protectores. De hecho, se puede argumentar que los animales macroscópicos no podrían haber desarrollado tal protección sin las OTP. Por lo tanto, está claro por qué las OTP han evolucionado y se han establecido en todos los filos superiores; hay muchas ventajas selectivas. El hecho de que varios tipos diferentes de OTP hayan evolucionado de forma independiente implica que varios de los filos animales se habían diferenciado antes de la explosión cámbrica, momento en el que se observa por primera vez la armadura corporal.
Las preguntas sobre cómo y exactamente cuándo evolucionaron las proteínas son más difíciles de responder. Como hemos visto anteriormente, es probable que muchas de las OTP surjan de proteínas monoméricas de unión al oxígeno (OBP): una proteína similar a la mioglobina para la hemoglobina, miohemeritrina para las hemeritrinas y tal vez una tirosinasa monomérica para las hemocianinas de moluscos y una fenoloxidasa para hemocianina de artrópodos[76].
En cualquier caso, el paso crítico para pasar de una OBP simple a una OTP compleja es establecer una estructura de proteína capaz de unirse de forma cooperativa. La unión cooperativa es importante para el suministro de oxígeno eficiente y es una característica de casi todas las OTP. La estructura más simple para lograr esto es una con dos sitios de unión. Dicha proteína se puede desarrollar de al menos dos formas: el producto proteico de un gen duplicado en tándem se puede plegar en un polipéptido en tándem con dos o más secuencias idénticas. Si estos dominios proteicos son capaces de interactuar de dos formas, con diferentes fuerzas de unión, se satisfacen los requisitos previos para la unión cooperativa y alosterio. Alternativamente, una copia de los genes monoméricos puede sufrir una mutación para conducir a una dimerización no covalente (u oligomerización superior).
Nuevamente, si existen conformaciones para tal complejo con diferentes afinidades por el oxígeno, es posible la unión cooperativa. Se han utilizado ambas vías, pero B parece ser mucho más común. La mayoría de las OTP son oligómeros enlazados no covalentemente. Cuándo evolucionaron las OTP es una pregunta mucho más difícil de responder. Sin embargo, podemos poner algunas limitaciones lógicas al problema:
(a) Un sistema de transporte de oxígeno es un requisito previo para el desarrollo de conchas o caparazones duros. No es posible respirar a través de ellos, por lo que se requiere el transporte desde las branquias o los pulmones. Esto requiere o es facilitado por una OTP. Esto significa, a su vez, que el desarrollo de OTP, al menos, en moluscos y artrópodos, debe haber ocurrido antes de la aparición de fósiles de conchas y artrópodos de cuerpo duro en el Cámbrico temprano.
(b) Debido a que diferentes phyla utilizan OTP bastante diferentes, que en muchos casos no tienen una ascendencia proteica común, concluimos que muchas o la mayoría de las OTP evolucionaron después de la divergencia de los principales phyla.
(c) La aparición independiente y la presencia de diferentes OTP en diferentes phyla aproximadamente al mismo tiempo argumenta que había un desafío evolutivo común que enfrentaban todos los organismos.
(d) Para formar OTP, la naturaleza ha desarrollado estrategias para unir dioxígeno sin reaccionar químicamente. Para esto, dos metales parecen ser ventajosos: hierro y cobre. El hierro estaba disponible en los océanos más antiguos, mientras que el cobre se volvió accesible solo después del gran evento de oxidación. Esto implica un origen anterior para las OTP a base de hierro.
Estos argumentos no nos llevan muy lejos en la asignación de fechas, pero en conjunto son bastante inconsistentes con la visión tradicionalista de que la divergencia de los principales filos animales ocurrió al comienzo del Cámbrico, el período al que a menudo se hace referencia como la "explosión cámbrica". Podríamos argumentar que la aparición de fósiles tanto de artrópodos como de moluscos en este momento es una consecuencia del desarrollo de caparazones duros (y aumento de tamaño) por los filos que ya existían de forma independiente durante algún tiempo. La posesión de un caparazón requiere la existencia previa de un sistema de transporte de oxígeno. Simplemente no funciona al revés. Pero eso también significa que ya se tenía que haber desarrollado una especie de bomba (un corazón) y al menos un sistema de circulación rudimentario. Las proteínas precursoras probables de las OTP parecen haberse desarrollado temprano. Por ejemplo, la tirosinasa tiene el mismo sitio activo que las hemocianinas[77] y ya están presentes en las esponjas que surgieron alrededor de 800MYA[78]. Si las OTP son de origen precámbrico, la pregunta es ¿qué tan temprano? Existe un creciente cuerpo de evidencia biológica molecular. Recuerde que la molécula de hemocianina de moluscos se construye a partir de subunidades, que a su vez son matrices en tándem de "unidades funcionales". Todas estas unidades se derivan claramente de un gen ancestral común, y podemos seguir la evolución de una unidad determinada a través de la evolución bien documentada de los moluscos. Los tiempos de divergencia de las clases de moluscos son bastante conocidos por el registro fósil. Esto proporciona una "escala de tiempo" para la evolución de la hemocianina de moluscos. Sobre esta base, encontramos que la divergencia inicial de las unidades funcionales es anterior a cualquier fósil de molusco conocido.
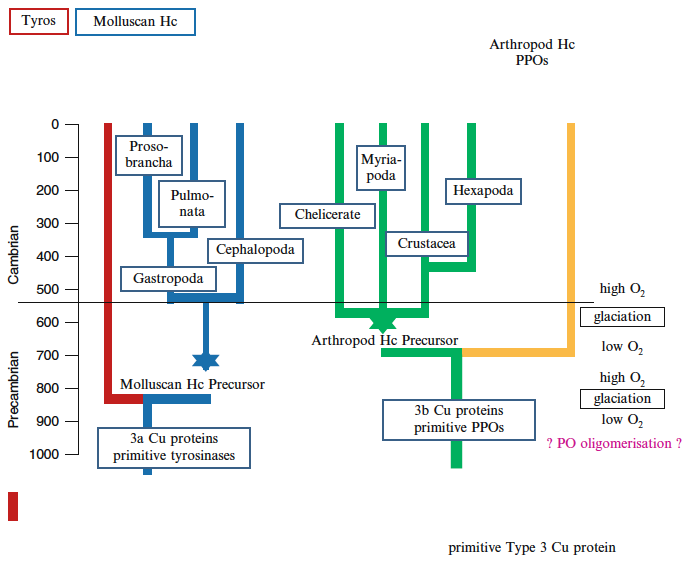
Fig. 5.12 Evolución postulada de hemocianina. Las proteínas de cobre primitivas de tipo 3 pueden haber evolucionado a tirosinasas (Tyros) o polifenoloxidasas relacionadas (PPO). Pueden considerarse como los antiguos precursores de las hemocianinas.
De hecho, se indica una fecha de aproximadamente 700 MYA. Esto corresponde o es anterior a la gran glaciación del Proterozoico, pero es posterior a la evolución de las esponjas. Se puede atribuir una fecha muy similar a la divergencia inicial de las unidades de globina de la hemoglobina de los artrópodos branquiópodos. El origen de las hemocianinas de artrópodos también se ha estimado entre 600 y 700 MYA. Creemos que durante este período, todas o la mayoría de las clases existentes de OTP evolucionaron a partir de ancestros monoméricos. El problema con esta hipótesis es la escasez de registros fósiles en este período, lo que indica que los organismos en los que evolucionaron debieron ser pequeños y de cuerpo blando. Si es así, ¿por qué evolucionaron las OTP? Nos damos cuenta de que existe una fuerte oposición científica a este punto de vista. No obstante, la idea de que organismos complejos con sistemas circulatorios en funcionamiento surgieron de la nada a partir de la “explosión cámbrica” tampoco parece razonable.
¿Fue una bola de nieve en la tierra un posible desencadenante para OPT? ¿Evolución?
Hemos argumentado anteriormente que el transporte de oxígeno mediado por proteínas debe haber evolucionado antes de 550 MYA, pero ciertamente no antes de aproximadamente 800 MYA, la edad de las esponjas fósiles más antiguas. Un límite superior de 700 MYA parece ser creíble. Curiosamente, este lapso se corresponde estrechamente con dos grandes glaciaciones mundiales: la Sturtian (710–680 MYA) y la Varanjer-Marinean (605–585 MYA) (consulte el capítulo 6 para obtener más detalles). Se ha sugerido[79] que los episodios de la “Tierra de bolas de nieve”, que debieron haber sido desastres ecológicos para muchas especies, de hecho pueden haber jugado un papel en el desencadenamiento de los estallidos evolutivos que siguieron. Podríamos sugerir que en lugar de "desencadenantes", la glaciación actuó como "pantallas", separando el ajuste de los no aptos.
La cobertura de gran parte de la superficie de la Tierra y los mares con hielo habría inhibido en gran medida la fotosíntesis con la consiguiente disminución de los niveles de oxígeno en los océanos[80]. Esto requería entonces que los aerobios para sobrevivir debían permanecer muy pequeños, muy delgados o desarrollar sistemas de transporte de oxígeno para extraer de manera más eficiente el poco dioxígeno disponible. Está claro que todos los animales precámbricos permanecieron pequeños (excepto Ediacarans, que, sin embargo, eran delgados), pero sugerimos que los más exitosos fueron aquellos que también desarrollaron transporte de dioxígeno. Estos luego sobrevivieron en el Cámbrico y fueron fácilmente capaces de desarrollar armaduras protectoras y otras partes duras contra la depredación que destruyó a los ediacaranos de cuerpo blando. No es necesario postular una misteriosa "explosión" evolutiva, sino la oportunidad de que varios tipos de criaturas sobrevivan y ocupen nuevos nichos que surgieron después de que se fueron los glaciares. Podría haber existido una buena posibilidad de que sin la extinción de muchas especies por dos glaciaciones, la Tierra todavía estaría poblada por organismos primitivos.
Qué proteínas transportaron el oxígeno a las proteínas ¿Evolución?
Debido a que las OTP no tendrían ninguna función hasta que hubieran evolucionado aerobios bastante complejos, debemos asumir que las proteínas mismas se derivan de algunas proteínas previamente existentes; pero cuáles? Para las hemoglobinas, han realizado un análisis extenso de muchas proteínas eucariotas, bacterianas y arqueales[81]. Su conclusión es que toda la hemoglobina existente puede haber surgido de una proteína sensor de oxígeno muy antigua, en la que un hemo está funcionalmente acoplado a una fracción flavina que transmite la señal. Al principio, estos pueden haber señalado una advertencia de oxígeno, pero cuando aparecieron los aerobios, llevaron a la búsqueda de oxígeno. Por otro lado, las hemocianinas pueden haberse desarrollado como resultado de la modificación de las enzimas fenoloxidasas, especialmente tirosinasas. Fueron necesarios para neutralizar el aumento concentraciones de dioxígeno formando difenoles y quinonas que también son necesarios para endurecer la cutícula de los artrópodos. Las fenoloxidasas comparten con las hemocianinas el mismo sitio activo y mecanismo de activación[82]. Así, en todos los casos, al menos es posible asignar precursores razonables, que realizaban funciones útiles antes de que surgiera la necesidad de transporte de oxígeno.
Proteínas de transporte de oxígeno y "diseño inteligente"
Hay una rama del pensamiento creacionista que sostiene que el darwinismo no puede, en principio, explicar la diversidad y complejidad existente de los organismos y su metabolismo. Más bien, se propone que la evolución ha sido guiada por un “diseñador inteligente” que ha ayudado a resolver los problemas encontrados en el desarrollo de estructuras y procesos complejos. Es esclarecedor considerar la evolución de las OTP a este respecto. Recuerde que existen varias clases de tales proteínas, que esencialmente no tienen similitud estructural entre sí. También tenga en cuenta que el gen de la hemoglobina es muy antiguo y parece ser portado por todos los metazoos superiores, incluidos en particular los artrópodos y moluscos. Pero casi todas las especies de artrópodos y moluscos que emplean una proteína de transporte usan hemocianinas para este propósito. Uno supondría que el "diseñador", si fuera inteligente, simplemente habría utilizado el gen de la globina ya disponible para crear proteínas de transporte en todos los filos, en lugar de tener que inventar nuevas soluciones para los artrópodos y moluscos (y hemeritrinas para algunos phyla menores). El hecho de que algunos artrópodos y moluscos utilizan hemoglobinas únicas demuestra que se podría haber empleado hemoglobina.
No es que las hemocianinas posean alguna ventaja intrínseca sobre la hemoglobina. De hecho, en términos de eficiencia como portadores de oxígeno (masa de proteína necesaria para transportar una molécula de oxígeno), las hemoglobinas son de tres a cuatro veces más eficientes que las hemocianinas. Todo lo que pueden hacer las hemocianinas, las hemoglobinas lo pueden hacer a menor costo para el organismo. Se cree que la masa adicional es necesaria para construir las áreas de contacto entre las subunidades que establecen interacciones cooperativas.
Entonces hay que concluir que el “diseñador”, si existe, es descuidado o poco inteligente. La idea de un “diseñador tonto” debería resultar poco atractiva incluso para el creacionista más ardiente. Por otro lado, el tipo peculiar de distribución filogenética de las OTP que observamos es exactamente lo que se habría esperado de la selección natural darwiniana. Cuando las circunstancias dieron ventaja a aquellos phyla que ya habían desarrollado OTP, esos organismos sobrevivieron. Pero hay muchas formas de desarrollar una OTP a partir de proteínas preexistentes mediante una simple mutación. Varios diferentes ocurrieron en filos separados y sus portadores fueron seleccionados posteriormente.
Referencias
[1] Teychené, Johanne. (2017). Caractérisation multi-échelle des interactions sucre-électrolyte pour une meilleure compréhension du transfert en nanofiltration.
[2] Peres, Patricia & Júnior, Walter & Bonilla-Rodriguez, Gustavo. (2004). Allosteric water and phosphate effects in Hoplosternum littorale hemoglobins. European journal of biochemistry / FEBS. 271. 4270-4. 10.1111/j.1432-1033.2004.04366.x.
[3] Peres, P & Lombardi, Fabio & Santos, G.C. & Olivieri, J.R. & Canduri, F & Bonilla-Rodriguez, Gustavo & De Azevedo Jr, Walter. (2005). Molecular modeling and small angle X-ray scattering studies of Hoplosternum littorale cathodic haemoglobin. Biochemical and biophysical research communications. 325. 487-93. 10.1016/j.bbrc.2004.10.061.
[4] Gosenca, Mateja & Adamek, Julian & Byrnes, Christian & Hotchkiss, Shaun. (2017). 3D simulations with boosted primordial power spectra and ultracompact minihalos. Physical Review D. 96. 10.1103/PhysRevD.96.123519.
[5] Valiante, Rosa & Colpi, Monica & Schneider, Raffaella & Mangiagli, Alberto & Bonetti, Matteo & Cerini, Giulia & Fairhurst, Stephen & Haardt, Francesco & Mills, Cameron & Sesana, Alberto. (2020). Unveiling early black hole growth with multi-frequency gravitational wave observations.
[6] Trimble, Virginia. (2020). The Origin and Evolution of the Chemical Elements. 10.1142/9789811206467_0003.
[7] Rauchfuss, Horst. (2005). Chemische Evolution und der Ursprung des Lebens. 10.1007/3-540-27666-1.
[8] Heuseler H, Jaumann R, Neukum G (2000) Zwischen Sonne und Pluto. BLV, M€unchen
[9] Weigert A, Wendker JH, Wisotzki L (1996) Astronomie und Astrophysik, 4 Aufl. VCH, Weinheim
[10] O’Neil J, Carlson RW, Francis D, Stevenson RK (2008) Neodymium-142 evidence for Hadean Mafic crust. Science 321:1828–1831
[11] Seki K, Elphic RC, Hirahara M, Terasawa T, Mukai T (2001) On atmospheric loss of oxygen ions
from Earth through magnetospheric processes. Science 291:1939–1941
[12] Press F, Siefer R (1995) Allgemeine Geologie. Spektrum-Verlag, Heidelberg
[13] Wills C, Bada J (2000) The spark of life. Perseus, Cambridge, MA
[14] Münker C, Pfander J, Weyer S, Bühl A, Kleine T, Mezger K (2003) Evolution of planetary cores
and the Earth – Moon system from Nb/Ta systematics. Science 301:84–87
[15] Wacey D (2009) Early life on Earth: a practical guide. Springer, New York
[16] Quenzel H (1987) Die Entwicklung der Erdatmosphare. In: Wilhelm F (Hrsg) Gang der Evolution.
Beck Verlag, M€unchen
[17] Delsemme AH (1992) Cometary origin of carbon, nitrogen and water on the Earth. Orig Life Evol
Biosph 21:279–298
[18] Robert F (2001) The origin of water on Earth. Science 293:1056–1058
[19] Sagan C, Mullen G (1972) Earth and Mars: evolution of atmospheres and surface temperatures.
Science 177:52–56
[20] Kasting JF, Howard MZ (2006) Atmospheric composition and climate on the Early Earth. Philos
Trans R Soc Lond B Biol Sci 361:1733–1742
[21] Owen T, Cess RD, Ramanathan V (1979) Enhanced CO2 greenhouse to compensate for reduced
solar luminosity on early Earth. Nature 277:640–642
[22] Kasting JF (1991) Box models for the evolution of atmospheric oxygen: an update. Glob Planet
Change 97:125–131
[23] Hamanaka RB, Chandel NS (2010) Mitochondrial reactive oxygen species regulate cellular
signaling and dictate biological outcomes. Trends Biochem Sci 35:505–513
[24] van Kuijk FJ, Dratz EA (1987) Detection of phospholipid peroxides in biological samples. Free
Radic Biol Med 3:349–354
[25] Bodaness RS, Chan PC (1977) Singlet oxygen as a mediator in the hematoporphyrin-catalyzed
photooxidation of NADPH to NADPþ in deuterium oxide. J Biol Chem 252:8554–8560
[26] Krieger-Liszkay A (2005) Singlet oxygen production in photosynthesis. J Exp Bot 56:337–346
[27] Cleaves HJ, Miller SL (2001) The nicotinamide biosynthetic pathway is a by-product of the RNA
world. J Mol Evol 52:73–77
[28] Castresana J, Saraste M (1995) Evolution of energetic metabolism: the respiration-early hypothesis.
Trend Biochem Sci 20:443–448
[29] Doolittle WF (1998) A paradigm gets shifty. Nature 392:15–16
[30] Lallier FH (2006) Thioautotrophic symbiosis: towards a new step in eukaryotic evolution. Cah
Biol Mar 47:391–396
[31] Rumpho ME, Worful JM, Lee J, Kannan K, Tyler MS, Bhattacharya D, Moustafa A, Manhart JR
(2008) Horizontal gene transfer of the algal nuclear gene psbO to the photosynthetic sea slug
Elysia chlorotica. Proc Natl Acad Sci USA 105:17867–17871
[32] König H, Fr€ohlich J, Lil L, Wenzel M, Berchtold M, Droge S, Breunig A, Pfeiffer P, Radek R,
Brugerolle G (2007) The flagellates of the Australian termite Mastotermes darwiniensis:
identification of their symbiotic bacteria and cellulases. Symbiosis 44:51–65
[33] Knoll AH, Javaux EJ, Hewitt D, Cohn P (2006) Eukaryotic organisms in Proterozoic oceans.
Philos Trans R Soc Lond B Biol Sci 361:1033–1038
[34] Cavalier-Smith T, Brazier M, Embley TM (2006) Introduction: how and when did microbes
change the world. Philos Trans R Soc Lond B Biol Sci 361:845–850
[35] Shixing Z, Huineng C (1995) Megascopic multicellular organism from the 1700 million-years-old
Tuanshanzi formation in the Jixian area, North China. Science 279:620–622
[36] Weiguo S (1994) Early multicellular fossils. In: Bengstron S (ed) Early life on earth. Colombia University Press, New York, pp 358–369
[37] Müller WEG, Li J, Schroder HC, Qiao L, Wang X (2001) The unique skeleton of siliceous sponges
(Porifera; Hexactinellida and Demospongiae) that evolved first from the Urmetazoa during the
Proterozoic: a review. Biogeosciences 4:219–232
[38] Reiger RM (1994) Evolution of the lower metazoan. In: Bengstron S (ed) Early life on earth.
Colombia University Press, New York, pp 475–488
[39] Fedonkin MA (1994) Vendian body forms and traces. In: Nengston S (ed) Early life on earth.
Columbia University Press, New York, pp 370–388
[40] McMenamin MAS (2003) Origin and early predators. In: Kelley P, Kowalewski M, Hansen T
(eds) Predator-prey interactions in the fossil record. Kluwer/Academic, New York, pp 379–400
[41] Bottjer DJ (2005) The early earth evolution of animals. Sci Am 293:42–47
[42] Fedonkin MA, Waggoner BM (1997) The Late Precambrian fossil Kimberella is a mollusc-like
bilaterian organism. Nature 388:868–871
[43] Conway-Morris S (2006) Darwin’s dilemma: the realities of the Cambrian ‘explosion’. Proc R Soc
Lond B Biol Sci 361:1069–1083
[44] Hedges SB, Blair JF, Venturi M, Shoe J (2004) A molecular timescale of eukaryote evolution and
the rise of complex multicellular life. BMC Evol Biol 4:2–10
[45] Mills, Daniel & Canfield, Donald. (2014). Oxygen and animal evolution: Did a rise of atmospheric oxygen “trigger” the origin of animals?. BioEssays. 36. 10.1002/bies.201400101.
[46] Smith, Andrew & Littlewood, D.T.J. & Wray, Gregory. (1995). Comparing Patterns of Evolution: Larval and Adult Life History Stages and Ribosomal RNA of Post-Palaeozoic Echinoids. Royal Society of London Philosophical Transactions Series B. 349. 10.1098/rstb.1995.0085.
[47] Corliss, Bruce & Delalio, Leon & Keller, T. & Keller, Alex & Keller, Douglas & Corliss, Bruce & Beers, Jody & Peirce, Shayn & Isakson, Brant. (2019). Vascular Expression of Hemoglobin Alpha in Antarctic Icefish Supports Iron Limitation as Novel Evolutionary Driver. Frontiers in Physiology. 10. 1389. 10.3389/fphys.2019.01389.
[48] Bilyk, Kevin & Zhuang, Xuan & Murphy, Katherine & Cheng, Chris. (2019). A tale of two genes: divergent evolutionary fate of haptoglobin and hemopexin in hemoglobinless Antarctic icefishes. 10.1242/jeb.188573..
[49] Isaza, Clara & Silaghi-Dumitrescu, Radu & Iyer, R.B. & Kurtz, Donald & Chan, M.K.. (2007). Structural Basis for O(2) Sensing By the Hemerythrin-Like Domain of a Bacterial Chemotaxis Protein: Substrate Tunnel And Fluxional N Terminus. Biochemistry. 45.
[50] Wood, Henry & Cruz Navarrete, Francisco & Baxter, Nicola & Trevitt, Clare & Robertson, Angus & Dix, Samuel & Hounslow, Andrea & Cliff, Matthew & Waltho, Jonathan. (2020). Allomorphy as a mechanism of post-translational control of enzyme activity. Nature Communications. 11. 10.1038/s41467-020-19215-9.
[51] Dolashka, Pavlina & Dolashki, Aleksandar & Stevanovic, Stefan & Hristova, Rumyana & Atanasov, Boris & Nikolov, Peter & Voelter, Wolfgang. (2005). Structure and stability of arthropodan hemocyanin Limulus polyphemus. Spectrochimica acta. Part A, Molecular and biomolecular spectroscopy. 61. 1207-17. 10.1016/j.saa.2004.06.043.
[52] Decker, Heinz & Holde, Kensal. (2011). Facilitated Oxygen Transport. 10.1007/978-3-642-13179-0_5.
[53] Bonaventura, Celia & Henkens, Robert & Friedman, Joel & Siburt, Claire & Kraiter, Daniel & Crumbliss, Alvin. (2011). Steric factors moderate conformational fluidity and contribute to the high proton sensitivity of Root effect hemoglobins. Biochimica et biophysica acta. 1814. 1261-8. 10.1016/j.bbapap.2011.06.012.
[54] Barlow, Samantha & Metcalfe, Julian & Righton, David & Berenbrink, Michael. (2017). Life on the edge: O2 binding in Atlantic cod red blood cells near their southern distribution limit is not sensitive to temperature or haemoglobin genotype. The Journal of Experimental Biology. 220. 414-424. 10.1242/jeb.141044.
[55] Narayanan, Sreekala & Mathew, Boby & Srinivasu, Bindu & Mandal, Amit & Bhat, Vijay & Ross, Cecil. (2020). Effect of point mutation on structure–function correlation of hemoglobin variants, HbE and HbD Punjab. Amino Acids. 52. 1-12. 10.1007/s00726-020-02858-9.
[56] Harter, Till & Brauner, Colin. (2017). The O 2 and CO 2 Transport System in Teleosts and the Specialized Mechanisms That Enhance Hb–O 2 Unloading to Tissues. 10.1016/bs.fp.2017.09.001.
[57] Bonaventura, Celia & Crumbliss, A. & Weber, Roy. (2021). Theme: The Bohr Effect A Discovery 100 Years Ago with Intensive Studies Still Going On.
[58] Cordioli, Ricardo & Grieco, Domenico Luca & Charbonney, Emmanuel & Richard, Jean-Christophe & Savary, Dominique. (2018). New physiological insights in ventilation during cardiopulmonary resuscitation. Current Opinion in Critical Care. 25. 1. 10.1097/MCC.0000000000000573.
[59] Damsgaard, Christian. (2021). Physiology and evolution of oxygen secreting mechanism in the fisheye. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 252. 110840. 10.1016/j.cbpa.2020.110840.
[60] Dichiera, Angelina & Esbaugh, Andrew. (2020). Red blood cell carbonic anhydrase mediates oxygen delivery via the Root effect in red drum. Journal of Experimental Biology. 223. 10.1242/jeb.232991.
[61] Belato, Flavia & Coates, Christopher & Halanych, Ken & Weber, Roy & Costa-Paiva, Elisa. (2020). Evolutionary History of the Globin Gene Family in Annelids. Genome Biology and Evolution. 12. 1719-1733. 10.1093/gbe/evaa134.
[62] Riciluca, Katie & Borges, Calebe & Mello, J. & Oliveira, Ursula & Serdan, D. & Florez, Alfredo & Nishiyama Jr, Milton Y & Chaparro, Elisa & Cassago, A. & Junqueira-de-Azevedo, I. & Heel, Marin & da Silva Junior, Pedro & Portugal, Rodrigo. (2020). Myriapod haemocyanin: the first three-dimensional reconstruction of Scolopendra subspinipes and preliminary structural analysis of S. viridicornis. Open Biology. 10. 10.1098/rsob.19.0258.
[63] Narayanan, Sreekala & Mathew, Boby & Srinivasu, Bindu & Mandal, Amit & Bhat, Vijay & Ross, Cecil. (2020). Effect of point mutation on structure–function correlation of hemoglobin variants, HbE and HbD Punjab. Amino Acids. 52. 1-12. 10.1007/s00726-020-02858-9.
[64] Royer WE Jr, Sharma H, Strand K, Knapp JE, Bhyravbhatia B (2006) Lumbricus erythrocruorin at
3.5 A resolution: architecture of a megadalton respiratory complex. Structure 14:116–1177
[65] Baxevanis, Athanasios & Kappas, Ilias & Abatzopoulos, Theodore. (2006). Molecular phylogenetics and sexuality in the brine shrimp Artemia. Molecular phylogenetics and evolution. 40. 724-38. 10.1016/j.ympev.2006.04.010.
[66] Herhold, Hollister & Davis, Steven & Grimaldi, David. (2020). Transcriptomes reveal expression of hemoglobins throughout insects and other Hexapoda. PLOS ONE. 15. e0234272. 10.1371/journal.pone.0234272.
[67] Araujo, Ana Carolina & Morillo, Viviana & Cypriano, Jefferson & Teixeira, Lia & Leão, Pedro & Lyra, Sidcley & Almeida, Luiz & Bazylinski, Dennis & Vasconcellos, Ana & Abreu, Fernanda & Lins, Ulysses. (2016). Combined genomic and structural analyses of a cultured magnetotactic bacterium reveals its niche adaptation to a dynamic environment. BMC Genomics. 17. 10.1186/s12864-016-3064-9.
[68] Shahbazi Raz, Farsheed & Amani, Vahid & Noruzi, Ehsan & Safari, Nasser & Boca, R. & Titiš, Ján & Notash, Behrouz. (2015). Synthesis, characterization, electrochemical and magnetic study of mixed ligand mono iron and O-methoxy bridged diiron complexes. Inorganica Chimica Acta. 435. 262–273. 10.1016/j.ica.2015.07.003.
[69] Costa-Paiva, Elisa & Schrago, Carlos & Halanych, Ken. (2017). Broad Phylogenetic Occurrence of the Oxygen-Binding Hemerythrins in Bilaterians. Genome Biology and Evolution. 9. 2580. 10.1093/gbe/evx181.
[70] Koco?, Anna & Nowak, Magdalena & K?y?, Ma?gorzata & Malejky-K?usek, Natalia. (2019). Czy jeste?my bezpieczni w naszych mieszkaniach?.
[71] Kato, Sanae & Matsui, Takashi & Gatsogiannis, Christos & Tanaka, Yoshikazu. (2017). Molluscan hemocyanin: structure, evolution, and physiology. Biophysical Reviews. 10. 10.1007/s12551-017-0349-4.
[72] Miller, KI & Cuff, Marianne. (1999). Crystal structure and protein sequence of Octopus hemocyanin reveal evolution's stamp. Comparative Biochemistry and Physiology A-molecular & Integrative Physiology - COMP BIOCHEM PHYSIOL PT A. 124. 10.1016/S1095-6433(99)90064-8.
[73] Gatsogiannis, Christos & Markl, Jürgen. (2008). Keyhole Limpet Hemocyanin: 9-Å CryoEM Structure and Molecular Model of the KLH1 Didecamer Reveal the Interfaces and Intricate Topology of the 160 Functional Units. Journal of molecular biology. 385. 963-83. 10.1016/j.jmb.2008.10.080.
[74] Malison, Rachel & Ellis, Bonnie & Delvecchia, Amanda & Jacobson, Hailey & Hand, Brian & Luikart, Gordon & Woods, H & Gamboa, Maribet & Watanabe, Kozo & Stanford, Jack. (2020). Remarkable anoxia tolerance by stoneflies from a floodplain aquifer. Ecology. 101. 10.1002/ecy.3127.
[75] Volbeda, A & Hol, W.. (1988). Structure of arthropodan hemocyanin. Progress in clinical and biological research. 274. 291-307.
[76] abbas, Suad & Hassan, Murtada & Hussain, Alaa. (2020). Study of the spectrophotometric determination of Copper ion (I) by Michler’s thioketone Reagent. IOP Conference Series: Materials Science and Engineering. 871. 012035. 10.1088/1757-899X/871/1/012035.
[77] Bonaventura, Celia & Henkens, Robert & Friedman, Joel & Siburt, Claire & Kraiter, Daniel & Crumbliss, Alvin. (2011). Steric factors moderate conformational fluidity and contribute to the high proton sensitivity of Root effect hemoglobins. Biochimica et biophysica acta. 1814. 1261-8. 10.1016/j.bbapap.2011.06.012.
[78] M€uller WE, Grebenjuk VA, Thakur NL, Thakur AN, Batel R, Krasko A, M€uller IM, Breter HJ
(2004) Oxygen-controlled bacterial growth in the sponge Suberites domuncula: toward a
molecular understanding of the symbiotic relationships between sponge and bacteria. Appl
Environ Microbiol 70:2332–2341
[79] Moore, Kelsey & Pajusalu, Mihkel & Gong, Jian & Sojo, Victor & Matreux, Thomas & Braun, Dieter & Bosak, Tanja. (2020). Biologically mediated silicification of marine cyanobacteria and implications for the Proterozoic fossil record. Geology. 48. 10.1130/G47394.1.
[80] Porter, Susannah. (1970). The Proterozoic Fossil Record of Heterotrophic Eukaryotes. 10.1007/1-4020-5202-2_1.
[81] Forti, Flavio & Boechi, Leonardo & Oliveira, Ana & Bikiel, Damian & Arroyo-Mañez, Pau & Nadra, Alejandro & Capece, Luciana & Bidon-Chanal, Axel & Marti, Marcelo & Estrin, Dario & Luque, F.. (2011). Molecular simulations of globins: Exploring the relationship between structure, dynamics and function.
[82] Hu, Yingxia & Wang, Yang & Deng, Junpeng & Jiang, Haobo. (2016). The structure of a prophenoloxidase (PPO) from Anopheles gambiae provides new insights into the mechanism of PPO activation. BMC Biology. 14. 10.1186/s12915-015-0225-2.
Autores:
Eduardo Ochoa Hernández
Nicolás Zamudio Hernández
Abraham Zamudio Durán
Lizbeth Guadalupe Villalon Magallan
Mónica Rico Reyes
Pedro Gallegos Facio
Gerardo Sánchez Fernández
Rogelio Ochoa Barragán